
| A. |  表示燃料燃烧反应的能量变化 | |
| B. | 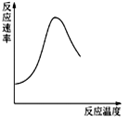 表示酶催化反应的反应速率随反应温度的变化 | |
| C. |  表示可逆反应从加入反应物开始建立化学平衡的过程 | |
| D. | 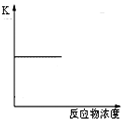 表示可逆反应的平衡常数随反应物浓度的变化 |
分析 A.燃料燃烧应放出热量,反应物总能量大于生成物总能量;
B.温度过高,酶失去催化活性;
C.从加入反应物开始建立化学平衡,平衡之前,正反应速率大于逆反应速率;
D.平衡常数只受温度的影响.
解答 解:A.燃料燃烧应放出热量,反应物总能量大于生成物总能量,而题目所给图为吸热反应,故A错误;
B.酶为蛋白质,温度过高,蛋白质变性,则酶催化能力降低,甚至失去催化活性,故B正确;
C.从加入反应物开始建立化学平衡,平衡之前,正反应速率大于逆反应速率,达到平衡时正逆反应速率相等,故C正确;
D.平衡常数只受温度的影响,温度不变,则平衡常数不变,故D正确.
故选A.
点评 本题考查较为综合,涉及化学反应与能量、化学平衡的影响,考查《化学反应原理》主要内容,侧重学生的分析能力的考查,为高考常见题型,易错点为B,注意蛋白质的性质,难度不大.


科目:高中化学 来源: 题型:解答题

 $→_{AlCl_{2}}^{RCl}$
$→_{AlCl_{2}}^{RCl}$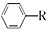
 $→_{HCl}^{Fe}$
$→_{HCl}^{Fe}$
 .
. .
.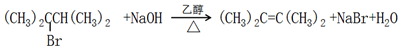 .
. .
.| 邻对位 定位基 | -CH3、-X、 -NH2、-NHCOR |
| 间位定位基 | -NO2,-COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a,b为石墨电极).下列说法中正确的是( )
用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a,b为石墨电极).下列说法中正确的是( )| A. | b电极反应式为O2+2H2O+4e-=4OH- | |
| B. | 电解时,a电极反应为:2Cl--2e-=Cl2↑ | |
| C. | 电解时,电子流动路径是:负极→外电路→b→溶液→a→正极 | |
| D. | 忽略能量消耗,当电池中消耗0.02gH2时,b极周围会产生0.02gH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 现象 | 结论 |
| A | 将浓硫酸滴到蔗糖表面 | 固体变黑膨胀 | 浓硫酸有吸水性和强氧化性 |
| B | 常温下将Al片放入浓硝酸中 | 无明显变化 | Al与浓硝酸不反应 |
| C | 将一小块Na放入水中 | Na块熔成小球 | Na的熔点低,且与水反应放出热量 |
| D | 用洁净的铂丝蘸取少量溶液在酒精灯上灼烧 | 火焰颜色呈黄色 | 溶液中不存在K+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、CO32-、Na+、NO3- | B. | NH4+、Al 3+、SO42-、NO3- | ||
| C. | K+、MnO4-、Cl -、SO42- | D. | Na+、NO3-、HSO3 -、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将NH3通入AgNO3溶液中,再加入几滴葡萄糖溶液,加热后有银镜产生,证明葡萄糖有氧化性 | |
| B. | 向KI溶液中加入少量的CCl4后振荡,未见蓝色,说明KI没有变质 | |
| C. | 少量金属钠和液溴均可保存在煤油中,浓硝酸和碳酸钠溶液均用带橡胶塞的细口、棕色试剂瓶盛放 | |
| D. | 除去溴苯中的溴可加入NaOH溶液振荡,再用分液漏斗分液,分液后再蒸馏便可得到纯净溴苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 如图所示,横轴为溶液的pH,纵轴为Zn2+或ZnO22-物质的量浓度的对数.回答下列问题:
如图所示,横轴为溶液的pH,纵轴为Zn2+或ZnO22-物质的量浓度的对数.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol乳酸( )能与1mol Na完全反应 )能与1mol Na完全反应 | |
| B. | 一氯甲烷(CH3Cl)和二氯乙烷(ClCH2CH2Cl)是同系物 | |
| C. | 丁烷有2种同分异构体,因此丁醇也有两种同分异构体 | |
| D. | 丙烯能使溴水褪色,丙烯分子中最多有7个原子位于同一平面内 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com