
| A. | O2是氧化剂,Fe2+和S2O32-是还原剂 | |
| B. | 每生成1molFe3O4,则转移电子数为2mol | |
| C. | 参加反应的氧化剂与还原剂的物质的量之比为1:1 | |
| D. | 若有2molFe2+被氧化,则被Fe2+还原的O2为0.5mol |
分析 A.所含元素化合价降低得到反应物是氧化剂,所含元素化合价升高的反应物是还原剂.结合方程式中元素化合价变化判断.
B.反应中只有氧气中氧元素的化合价降低,由0价升高为-2价,据此计算转移电子物质的量.
C.所含元素化合价降低得到反应物是氧化剂,所含元素化合价升高的反应物是还原剂.结合方程式计算判断.
D.根据部分电子转移守恒计算.
解答 解:在3Fe2++2S2O32-+O2+4OH-=Fe3O4+S4O62-+2H2O中,化合物中铁元素、硫元素用平均化合价,铁元素的化合价变化:+2→+$\frac{8}{3}$,硫元素的化合价变化为:+2→+$\frac{5}{2}$,氧元素的化合价变化:0→-2,所以氧化剂是O2,还原剂是Fe2+、S2O32-,
A.由上述分析可知,还原剂是Fe2+、S2O32-,氧化剂是O2,故A正确;
B.由方程式可知,每生成1molFe3O4,参加反应的氧气为1mol,转移电子数为1mol×4=4mol,故B错误;
C.由上述分析可知,氧化剂是O2,还原剂是Fe2+、S2O32-,3molFe2+参加反应时只有2mol被氧化,参加反应的氧化剂与还原剂的物质的最之比为1:(2+2)=1:4,故C错误;
D.2molFe2+被氧化时,失去电子2mol,则被Fe2+还原的O2的物质的量为:$\frac{2mol}{4}$=0.5mol,故D正确;
故选AD.
点评 本题考查氧化还原反应的基本概念与计算,题目难度中等,Fe3O4是复杂的化合物,铁元素既有+2价也有+3价,把Fe3O4中铁元素的化合价用平均化合价处理,S2O32-的硫元素的化合价用平均化合价处理是解本题的关键.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 反应4Al(s)+3O2(g)=2Al2O3 (s) 的△S>0 | |
| B. | 吸热反应都需要在加热条件下才能进行 | |
| C. | 同温同压下,H2 (g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H相同 | |
| D. | 已知:①S(s)+O2(g)=SO2(g)△H=-a kJ•mol-1, ②S(g)+O2(g)=SO2(g)△H=-b kJ•mol-1,则a>b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑤ | B. | ③④⑥ | C. | ①②③④⑤ | D. | 全部可以 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 遇苯酚变紫色的溶液:Na+、Mg2+、SO42-、Cl- | |
| B. | 使甲基橙变红色的溶液:NH4+、Cu2+、ClO-、Cl- | |
| C. | 0.1mol/LNaHCO3溶液:K+、AlO2-、Cl-、NO3- | |
| D. | 0.1mol/L(NH4)2Fe(SO4)2溶液中:K+、Cu2+、Cl-、MnO4- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X原子的电子层数比Y原子的电子层数少 | |
| B. | 酸性:HXO4>HYO4 | |
| C. | X的气态氢化物比Y的气态氢化物稳定 | |
| D. | Y的单质能将X从NaX的溶液中置换出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶质的质量分数为ω=$\frac{a}{Vρ-a}$×100% | |
| B. | 溶质的物质的量浓度c=$\frac{1000a}{17V}$mol•L-1 | |
| C. | 溶液中c (OH-)=$\frac{b}{V}$mol•L-1 | |
| D. | 上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最简单氢化物的还原性:X<Z | |
| B. | 单质的沸点:W>Z | |
| C. | 原子半径:Z>Y>X>W | |
| D. | X、Y、Z不可能存在于同一离子化合物中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
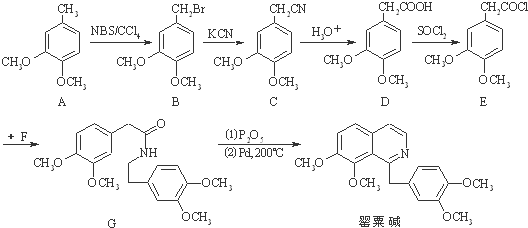
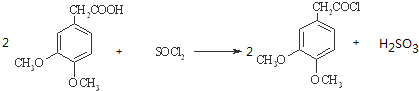 .
.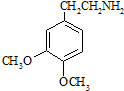 .
.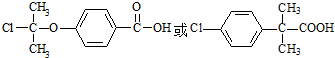 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com