
���� 2KMnO4+16HCl=2KCl+2MnCl2+5Cl2��+8H2O�У�MnԪ�صĻ��ϼ���+7�۽���Ϊ+2�ۣ�ClԪ�صĻ��ϼ���-1������Ϊ0���÷�Ӧ��ת��10e-���Դ������
��� �⣺��1��Mn�õ����ӣ�Clʧȥ���ӣ��÷�Ӧ��ת��10e-����˫���ŷ�����ʾ�÷�Ӧ����ת�Ƶķ������ĿΪ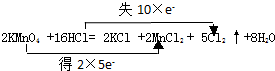 ��
��
�ʴ�Ϊ��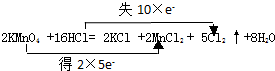 ��
��
��2��MnԪ�صĻ��ϼ۽��ͣ�ClԪ�صĻ��ϼ����ߣ���KMnO4Ϊ��������HClΪ��ԭ�����������ͻ�ԭ�����ʵ���֮��Ϊ2��10=1��5���ʴ�Ϊ��KMnO4��HCl��1��5��
��3���ڸ÷�Ӧ��HCl���ֳ��������л�ԭ�Ժ����ԣ��ʴ�Ϊ����ԭ�����ԣ�
��4��������ת�Ƶ���ĿΪ6.02��1023��ʱ����ת��1mol���ӣ����ɵ����������ʵ���Ϊ1mol��$\frac{5}{10}$=0.5mol���ʴ�Ϊ��0.5mol��
���� ���⿼��������ԭ��Ӧ��Ϊ��Ƶ���㣬���շ�Ӧ��Ԫ�صĻ��ϼ۱仯Ϊ���Ĺؼ�������������ԭ��Ӧ�����������Ŀ��飬��Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ԫ�� | B�� | ԭ�� | C�� | ���� | D�� | ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 �������ᣨ��ͼ��������ֲ���������Ƽ�����
�������ᣨ��ͼ��������ֲ���������Ƽ�����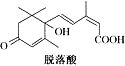 �жԸ����ʵ�������ȷ���ǣ�������
�жԸ����ʵ�������ȷ���ǣ�������| A�� | �����ʽΪC15H22O4 | |
| B�� | �����ڷ����廯���� | |
| C�� | ��������������Һ��Ӧ����������̼��������Һ��Ӧ | |
| D�� | ��������һ�������¿ɷ�������ȡ����Ӧ���ɺ���Ԫ�������ʣ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
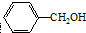 ���������������Ϻ͵�ζ���������������������潺���ҵ���������ά�ȵ��ܼ����״��ĺ�����ͬ���칹���У�������
���������������Ϻ͵�ζ���������������������潺���ҵ���������ά�ȵ��ܼ����״��ĺ�����ͬ���칹���У�������| A�� | 3�� | B�� | 4�� | C�� | 5�� | D�� | 6�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����£�0.2 molFe������ˮ������Ӧ�����ɵ�H2������ĿΪ$\frac{4}{15}$NA | |
| B�� | 1molNa2O2�����к���������Ϊ4NA | |
| C�� | ����ȼ�ϵ����������22.4L����״��������ʱ����·��ͨ���ĵ�����ĿΪ4NA | |
| D�� | 5NH4NO3$\frac{\underline{\;\;��\;\;}}{\;}$2HNO3+4N2��+9H2O��Ӧ�У�����28gN2ʱ��ת�Ƶĵ�����ĿΪ3.75NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | a=b | B�� | c��H+��=c��OH-��=10-7mol/L | ||
| C�� | ���Һ��Kw=c2��OH-�� | D�� | c��H+��+c��B+��=c��OH-��+c��A-�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com