
【题目】实验室用浓盐酸和MnO2制Cl2,并以干燥的Cl2为原料进行实验,装置如下图所示。

(1)装置B、C中应盛放的试剂名称分别为__________、_________;从A装置导出的气体若不经过B、C装置而直接进入D管,将对实验产生的不良后果是___________________________。
(2)实验时,先点燃A处的酒精灯,让氯气充满装置,再点燃D处酒精灯,写出D中反应的化学方程式:______________________。
(3)F装置所起的作用是____________________,____________________。
(4)用石灰乳吸收氯气可制得漂粉精,写出工业制漂粉精反应的化学方程式: _________________。
【答案】饱和食盐水 浓硫酸 未经除去的氯化氢和水蒸气随氯气进入D中和铁能反应生成氢气,氢气和氯气混合会发生爆炸 2Fe+3Cl2![]() 2FeCl3 吸收多余的氯气,防止污染环境 防止空气中的水蒸气进入E中 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
2FeCl3 吸收多余的氯气,防止污染环境 防止空气中的水蒸气进入E中 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
【解析】
(1)浓盐酸具有挥发性,所以氯气中含有氯化氢,氯化氢极易溶于水,氯气难溶于饱和食盐水,所以选饱和食盐水除去氯化氢,题中指出以干燥的Cl2为原料,所以还要除去氯气中混有的水蒸气,且不引入新的杂质,故选浓硫酸。
(2)铁粉与氯气在点燃条件下反应生成氯化铁。
(3)氯气有毒,污染环境,所以不能直接排放到空气中。
(4)氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水。
(1)浓盐酸具有挥发性,所以氯气中含有氯化氢,氯化氢极易溶于水,氯气难溶于饱和食盐水,所以选饱和食盐水除去氯化氢,题中指出以干燥的Cl2为原料,所以还要除去氯气中混有的水蒸气,且不引入新的杂质,故选浓硫酸,因浓盐酸具有挥发性,反应生成物中有水,在加热条件下变成水蒸气,所以混合气体中的成分是氯化氢、水蒸气、氯气;氯化氢、水蒸气和铁能反应生成氢气,氢气和氯气混合在加热时会发生爆炸,故答案为:饱和食盐水;浓硫酸;未经除去的氯化氢和水蒸气随氯气进入D中和铁能反应生成氢气,氢气和氯气混合会发生爆炸。
(2)铁粉与氯气在点燃条件下反应生成氯化铁,方程式为:2Fe+3Cl2![]() 2FeCl3,故答案为:2Fe+3Cl2
2FeCl3,故答案为:2Fe+3Cl2![]() 2FeCl3。
2FeCl3。
(3)氯气有毒,污染环境,所以不能直接排放到空气中,碱石灰的成分是氧化钙和氢氧化钠,氯气和氧化钙、氢氧化钠能反应,所以可用碱石灰处理尾气,空气中有水蒸气,碱石灰还能吸收水蒸气,防止空气中的水蒸气进入E中,所以可作干燥剂,故答案为:吸收多余的氯气,防止污染环境;防止空气中的水蒸气进入E中。
(4)氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水,反应方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O ,故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】下列反应不属于四种基本反应类型,但属于氧化还原反应的是( )
A. Fe+CuSO4=FeSO4+Cu
B. 3CO+Fe2O3![]() 2Fe+3CO2
2Fe+3CO2
C. AgNO3+NaCl=AgCl↓+NaNO3
D. 2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】脱硫渣是铁水在进入转炉前进行脱硫处理时产生的废弃物,现以某工厂废弃的脱硫渣(主要成分为Fe、CaO及少量MgO、Al2O3、SiO2)为原料,制备高纯度硫酸亚铁晶体的流程如下:
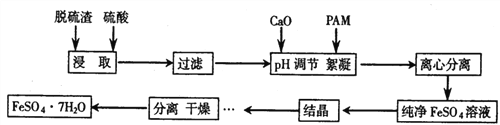
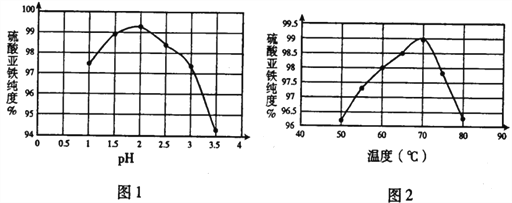
(1)在结晶过程中,pH、温度对硫酸亚铁纯度的影响如图1、图2,则蒸发结晶时适宜的条件为_____。
(2)离心分离后在30℃下干燥6h后得高纯度硫酸亚铁晶体,30℃下干燥其原因可能是______。
(3)实验室进行过滤操作时所需用到的玻璃仪器有_______。
(4)硫酸亚铁晶体可用来净化硫酸亚铁晶体可用来净化含K2Cr2O7废水,取一定质量的FeSO4·7H2O 和足量的KOH溶液加入到含K2Cr2O7废水中可得到一定量的磁性材料Cr0.5Fe1.5FeO4,处理含5.00×10-3mol K2Cr2O7的废水,需要多少克的FeSO4·7H2O(写出计算过程)。_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E都是周期表中前四周期的元素,它们的原子序数依次增大。其中A元素原子的核外p电子数比s电子数少1。C是电负性最大的元素。D原子次外层电子数是最外层电子数2倍,E是第Ⅷ族中原子序数最小的元素。
(1)写出基态C原子的电子排布式_________________。
(2)A、B两种元素的第一电离能由大到小的顺序为______________(用元素符号表示),原因是___________________。
(3)已知DC4常温下为气体,则该物质的晶体类型是_________,组成微粒的中心原子的轨道杂化类型为____________,空间构型是___________。
(4)Cu2+容易与AH3形成配离子[Cu(AH3)4]2+,但AC3不易与Cu2+形成配离子,其原因是______________________。
(5)A、B两元素分别与D形成的共价键中,极性较强的是__________。A、B两元素间能形成多种二元化合物,其中与A3—互为等电子体的物质的化学式为__________。
(6)已知E单质的晶胞如图所示,则晶体中E原子的配位数为__________,一个E的晶胞质量为___________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】300℃时,将100mL由H2O、CO2和N2组成的混合气体通入盛有足量Na2O2的密闭容器中(容器体积保持不变),充分反应后恢复到原温度时容器内的压强变为原来的4/5,则原混合气体中N2的体积分数为
A. 33.3% B. 40% C. 60% D. 75%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25 ℃时有关弱酸的电离平衡常数如下表:
弱电解质化学式 | CH3COOH | HCN | H2CO3 | NH3.H2O |
电离平衡常数 | 1.8×10-5 | 4.9×10-10 | K1=4.4×10-7 K2=4.7×10-11 | 1.8×10-5 |
下列推断正确的是( )
A. 25℃时,同浓度的下列溶液 pH 关系为:pH(NaHCO3)>pH(NaCN)>pH(CH3COONa)
B. 若25℃时某溶液中c(CO32-)=c(HCO3-),则此溶液中 c(H+)=4.7×10-11 mol·L-1
C. 若25℃时某溶液中c(CO32-)=c(HCO3-),往该溶液中滴入少量盐酸后, c(CO32-)>c(HCO3-)
D. 25℃时等浓度的NaCN和NH4Cl溶液,前者的阴离子浓度之和大于后者的阳离子浓度之和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按下列要求填空:
(1)已知99 ℃时,水的离子积常数Kw=1.0×10-12,该温度下测得0.1 mol·L-1 Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为_________________________。
②体积相等、pH=1的盐酸与H2A溶液分别与足量Zn反应,产生的氢气___(填编号)。
A.盐酸多 B.H2A多 C.一样多 D.无法确定
③将0.1 mol·L-1 H2A溶液与0.2 mol·L-1氨水等体积混合,完全反应后溶液中各离子浓度从大到小的顺序为__________________________________。
(2)常温下,HNO2 的电离常数Ka=7.1×10-4mol·L-1,NH3·H2O的电离常数Kb=1.7×10-5mol·L-1。0.1mol·L-1 NH4NO2 溶液中离子浓度由大到小的顺序是__________________
(3)在强酸性的电解质水溶液中,惰性材料做电极,电解CO2可得到多种燃料,其原理如图所示。

① 乙烯电子式为_________
②b电极的名称是_________
③请写出电解时生成乙烯的电极反应式____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
(1)Fe2O3是主氧化剂,与Na发生置换反应生成的还原产物为________(填化学式)。
(2)KClO4是助氧化剂,其中含有化学键的类型为________________________。
(3)NaHCO3是冷却剂,吸收产气过程中释放的热量而发生分解,其化学方程式为
________________________________________________________________。
(4)NaN3是气体发生剂,受热分解产生N2和Na。取56 g上述产气药剂,分解产生的气体通过碱石灰后的体积为16.8 L(标准状况),该产气药剂中NaN3的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,下列说法不正确的是 ( )

A. 图Ⅰ表示向AlCl3溶液中滴加氨水至过量
B. 图Ⅱ表示向NaOH溶液中滴加AlCl3溶液至过量且边滴边振荡
C. 图Ⅲ表示向NaAlO2溶液中滴加稀盐酸至过量且边滴边振荡
D. 图Ⅳ表示向NaAlO2溶液中缓慢通入二氧化碳至过量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com