
| A. | 5 | B. | 5.5 | C. | 9 | D. | 11 |
分析 结合Ksp=c(Mg2+)c2(OH-)可知,c(OH-)=$\sqrt{\frac{1.8×1{0}^{-11}}{0.18}}$=10-5mol/L,以此来解答.
解答 解:常温下Mg(OH)2的Ksp=1.8×l0-11,若要使0.18mol/L的MgCl2溶液生成Mg(OH)2沉淀,c(OH-)=$\sqrt{\frac{1.8×1{0}^{-11}}{0.18}}$=10-5mol/L,c(H+)=10-9mol/L,则至少需要将溶液的pH调至9,
故选C.
点评 本题考查难溶电解质的溶解平衡,为高频考点,把握离子浓度与Ksp的关系、浓度与pH为解答的关键,侧重分析与应用能力的考查,注意Ksp的应用,题目难度不大.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
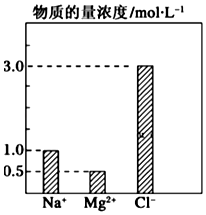 在0.2L由NaCl、MgCl2、BaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题:
在0.2L由NaCl、MgCl2、BaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
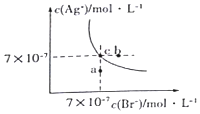 在t°C时,AgBr在水中的沉淀溶解平衡曲线如图所示.又知t°C时AgCl的Ksp=4×10-10,下列说法不正确的是( )
在t°C时,AgBr在水中的沉淀溶解平衡曲线如图所示.又知t°C时AgCl的Ksp=4×10-10,下列说法不正确的是( )| A. | 图中a点对应的是AgBr的不饱和溶液 | |
| B. | 在t°C时,AgBr的Ksp为 4.9×10-13 | |
| C. | 在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点 | |
| D. | 在t°C时,AgCl(s)+Br-(aq)?AgBr(s)+C1-(aq)的平衡常数K≈816 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A.图装置中X为苯,可用于吸收NH3或HCl,并防止倒吸 | B.图装置可用于铜与浓硫酸反应制取并收集二氧化硫 | C.图装置可用于硫酸铜溶液的蒸发浓缩,然后冷却制硫酸铜晶体 | D.记录滴定终点读数为12.20mL |
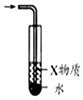 | 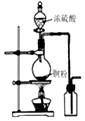 | 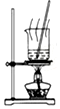 | 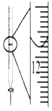 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
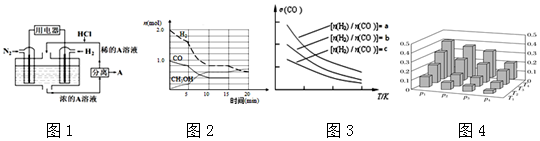
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 56g铁高温下与足量水蒸气充分反应转移电子数目为3NA | |
| B. | 100 g CaCO3和KHCO3混合固体中CO32-的数目为NA | |
| C. | 实验室用H2O2制备1mol O2转移的电子数为2NA | |
| D. | 标准状况下,2.24L CCl4含有的原子数为0.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com