
| A. | 一个化学反应是否能在常温下发生与该反应的△H值的大小没有必然联系 | |
| B. | 中和热△H=-57.3 kJ•mol-1,所以1.00 L 1.00 mol•L-1 H2SO4与稀的NaOH溶液恰好完全反应放出57.3 kJ的热量 | |
| C. | 用等体积的0.50 mol•L-1盐酸、0.55 mol•L-1 NaOH溶液进行中和热测定的实验,会使测得的值偏大 | |
| D. | 在101 kPa时,1 mol CH4完全燃烧生成CO2和水蒸气放出的热量就是CH4的燃烧热 |
分析 A、化学反应是否能在常温下发生与物质的稳定性有关;
B、中和热是H+和OH-反应生成1molH2O放出的热,1.00L 1.00mol•L-1H2SO4与稀的NaOH溶液恰好完全反应生成2mol水;
C、中和热是H+和OH-反应生成1molH2O放出的热;
D、根据燃烧热的概念:1mol可燃物完全燃烧生成稳定的氧化物,所放出的热量分析.
解答 解:A、化学反应是否能在常温下发生与物质的稳定性有关,与该反应的△H值的大小没有必然联系,故A正确;
B、中和热是H+和OH-反应生成1molH2O放出的热,1.00L 1.00mol•L-1H2SO4与稀的NaOH溶液恰好完全反应生成2mol水,所以放出的热量为57.3kJ×2,故B错误;
C、用等体积的0.50 mol•L-1盐酸、0.55 mol•L-1 NaOH溶液进行中和热测定的实验,测得的值不变,故C错误;
D、根据燃烧热的概念:1mol可燃物完全燃烧生成稳定的氧化物,所放出的热量为燃烧热,水的状态应该为液态,故D错误;
故选:A.
点评 本题考查学生反应热的有关知识,注意对中和热和燃烧热的概念理解,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 用酒精萃取碘水中的碘 | |
| B. | 分液时,分液漏斗中的两层液体均从下口放出 | |
| C. | 蒸馏时,应将温度计水银球靠近蒸馏烧瓶支管口处 | |
| D. | 称量NaOH固体时,将氢氧化钠固体放在托盘天平左盘的纸上 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
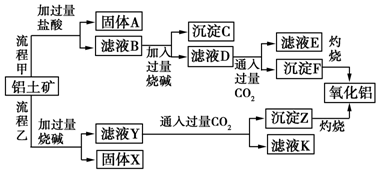
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4LO2中所含氧气分子计量为1摩尔 | |
| B. | 1mol氧含6.02×1023个O2 | |
| C. | 摩尔是国际科学界建议采用的一种物理量 | |
| D. | 摩尔是物质的量的单位,简称摩,符号为mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 体积V/mL | ||||
| K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
| ① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
| ② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
| ③ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 变质的植物油有难闻的气味,是因为植物油发生了酯化反应 | |
| B. | 水煤气的主要成分是丁烷 | |
| C. | 石油是混合物,其分馏产品汽油为纯净物 | |
| D. | 石油催化裂化的主要目的是提高汽油等轻质油的产量与质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用天平(用了游码)称量时,被称量物与砝码的位置放颠倒了 | |
| B. | 溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤 | |
| C. | 转移溶液前容量瓶内有少量蒸馏水 | |
| D. | 定容时,俯视容量瓶的刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com