
【题目】为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。
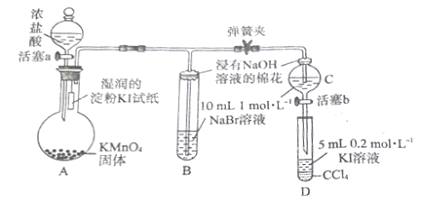
实验过程:
I.打开弹簧夹,打开活塞a,滴加浓盐酸;
Il.当B和C中的溶液都变为黄色时,夹紧弹簧夹;
III.当B中溶液由黄色变为棕红色时,关闭活塞a;
IV....
(1) A中产生黄绿色气体,其化学方程式是____________________________
(2) 验证氯气的氧化性强于碘的实验现象是_____________________________
(3) B中溶液发生反应的离子方程式是______________________________
(4) 为验证溴的氧化性强于碘,过程IV的操作和现象是______________________________
(5) 过程III实验的目的是_____________________________
(6)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下半径逐渐_______(填“增大”或“减小”),得电子能力逐渐______________(填“增强“或“减弱”)。
【答案】2K MnO4+16HCl(浓)=2KCl+2 MnCl2+5Cl2↑+8H2O 湿润的淀粉KI试纸变蓝 Cl2+2Br-=Br2+2Cl- 打开b,当C中KI溶液颜色变深时,关闭b,取下D振荡静置,CCl4层呈紫红色。 排除Cl2对Br2置换I2 的干扰 增大 减弱
【解析】
A中滴加浓盐酸后,发生反应:2KMnO4+16HCl(浓)=2KCl+ 2MnCl2+5Cl2↑+ 8H2O,生成黄绿色气体Cl2,在A、B、C中分别发生反应:Cl2+2KI=2KC1+I2、Cl2+2NaBr =2NaCl+ Br2、Cl2+2NaBr =2NaCl+ Br2,由于B、C中生成了Br2而使溶液变为黄色,打开活塞b,C中生成的Br2在D中发生反应:Br2+2KI =2KBr+I2。实验过程,当B中出现黄色溶液继续通入过量Cl2时,溶液变为红棕色,以此为对照,说明C中黄色溶液无Cl2,从而排除Cl2对溴置换碘实验的干扰。
(1) A中产生黄绿色气体为Cl2,其化学方程式是2KMnO4+16HCl(浓)=2KCl+ 2MnCl2+5Cl2↑+ 8H2O。答案 :2KMnO4+16HCl(浓)=2KCl+ 2MnCl2+5Cl2↑+ 8H2O。
(2)氯气遇到湿润的淀粉KI试纸时,发生反应:Cl2+2KI-=2KC1+I2,生成的I2可以使湿润的淀粉试纸变蓝,由此证明氯气的氧化性强于碘。答案:湿润的淀粉KI试纸变蓝。
(3)B中氯气与溴化钠反应生成氯化钠和溴单质,离子方程式为:Cl2+2Br-=Br2+2Cl- ;答案:Cl2+2Br-=Br2+2Cl-。
(4)C中的溴化钠与氯气反应生成氯化钠和Br2,将C中溶液滴入D中,发生反应:Br 2+2KI=2KBr+I2,振荡静置后D中溶液分层,下层为碘的四氯化碳溶液,呈紫色,说明溴的氧化性强于碘。答案:打开b,当C中KI溶液颜色变深时,关闭b,取下D振荡静置,CCl4层呈紫红色。
(5)确认C的黄色溶液中无Cl2,排除Cl2对溴置换碘实验的干扰。答案:排除Cl2对Br2置换I2 的干扰。
(6)根据元素周期律:同主族,从Cl到I,原子半径逐渐变大,得电子能力逐渐减弱,氧化性逐渐减弱。答案:增大;减弱。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.分子内共价键越强,分子越稳定,其形成的晶体的熔沸点也越高
B.离子键的本质就是阴、阳离子之间的相互吸引
C.金刚石转化为石墨的过程中不存在化学键被破坏的过程
D.由原子构成的晶体可能是原子晶体,也可能是分子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海带中提取碘单质,成熟的工艺流程如下:
干海带![]() 海带灰
海带灰![]()
![]() 滤液
滤液![]() 碘水
碘水![]() I2的CCl4溶液
I2的CCl4溶液![]() I2
I2
下列关于海带制碘的说法正确的是( )
A. 实验室可在蒸发皿中灼烧干海带,并用玻璃棒不断搅拌
B. 向含I-的滤液中加入稀硫酸和双氧水后,碘元素发生还原反应
C. 在碘水中加入几滴淀粉溶液,溶液变蓝色
D. 向碘水中加入CCl4得到I2的CCl4溶液,该操作为萃取,可用乙醇代替CCl4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于相同物质的量的SO2和SO3,下列说法中正确的是()。
A.硫元素的质量比为5:4B.分子数之比为1:1
C.原子总数之比为4:3D.质量之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100℃时,盐酸与氨水混合,所得溶液pH=7,则此溶液中的关系正确的是( )
A.c(NH4+)=c(Cl-)B.c(NH4+)<c(Cl-)C.c(NH4+)>c(Cl-)D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应3A(g)+2B(g) ![]() 4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是( )
4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是( )
A. 该反应的化学平衡常数表达式是![]()
B. 此时,B的平衡转化率是40%
C. 增大该体系的压强,化学平衡常数增大
D. 增加B,B的平衡转化率增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com