
| A. | 常温下,c(NH4+)相同的溶液中,溶质的物质的量浓度:c(NH3•H2O)>c(CH3COONH4)>c(NH4Cl)>c(NH4HSO4) | |
| B. | 常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Cl-)>c(NH4+)>c(H+)=c(OH-) | |
| C. | 中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量盐酸大于醋酸 | |
| D. | 将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均减小 |
分析 A.NH3•H2O为弱电解质存在电离平衡,电离程度微弱铵盐溶液中铵根离子水解,硫酸氢铵溶液中氢离子抑制铵根离子的水解,醋酸根离子促进铵根离子的水解;
B.溶液中存在电荷守恒分析判断;
C.pH与体积均相同的盐酸和醋酸溶液,醋酸溶液浓度大于盐酸;
D.醋酸溶液稀释,平衡状态下的离子浓度减小,溶液中存在离子积常数.
解答 解:A.NH3•H2O为弱电解质存在电离平衡,电离程度微弱铵盐溶液中铵根离子水解,硫酸氢铵溶液中氢离子抑制铵根离子的水解,醋酸根离子促进铵根离子的水解,常温下,c(NH4+)相同的溶液中,溶质的物质的量浓度:c(NH3•H2O)>c(CH3COONH4)>c(NH4Cl)>c(NH4HSO4),故A正确;
B.常温下,pH=7的NH4Cl与氨水的混合溶液中存在 电荷守恒,c(NH4+)+c(H+)=c(Cl-)+c(OH-),得到c(Cl-)=c(NH4+)>c(H+)=c(OH-),故B错误;
C.pH与体积均相同的盐酸和醋酸溶液,醋酸溶液浓度大于盐酸,中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量盐酸小于醋酸,故C错误;
D.将pH=4的醋酸溶液稀释后,溶液中醋酸电离平衡状态下离子的浓度均减小,溶液中氢氧根离子浓度增大,故D错误;
故选A.
点评 本题考查了弱电解质电离平衡和影响因素、盐类水解原理分析判断、电解质溶液中电荷守恒的理解应用,掌握基础是解题关键,题目难度中等.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | Na放入水中,产生气体:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | FeCl3溶液滴在淀粉碘化钾试纸上,试纸变蓝:2Fe3++2I-═2Fe2++I2 | |
| C. | 铁溶于稀硝酸,溶液变黄:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | |
| D. | 氯气溶于水:Cl2+H2O?H++Cl-+HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0×10-5 | B. | 0.001mol/L | C. | 1.8×10-7 | D. | 0.1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
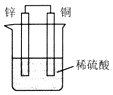
| A. | 锌是负极,其质量逐渐减少 | |
| B. | 电子由铜片经导线流向锌片 | |
| C. | H+在铜片表面被还原,产生气泡 | |
| D. | 锌片上发生氧化还原,铜片上发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ•mol-1表示.请认真观察图,然后回答问题.
在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ•mol-1表示.请认真观察图,然后回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由水电离出的氢离子浓度为10-10 mol•L-1 | |
| B. | 溶液中c(H+)•c(OH-)=1×10-14 | |
| C. | 溶液中c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | 溶液中c(NH3•H2O)+c(NH4+)=c(Cl-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用惰性电极电解NaCl溶液2H2O+2Cl-$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| B. | 铜片跟三氯化铁溶液反应:Fe3++Cu=Cu2++Fe2+ | |
| C. | 用FeSO4除去酸性废水中Cr2O72-:Cr2O72-+6Fe2++7H2O=2Cr3++6Fe3++14OH- | |
| D. | Fe3O4与稀HNO3反应:Fe3O4+8H+=Fe2++2Fe3++4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 固体氧化物燃料电池是一种新型的燃料电池,它是以固体氧化钇(Y2O3)、氧化锆(ZrO2)为解质,这种电解质在高温熔融状态下允许氧离子(O2-)在其间通过.某甲醇燃料电池的工作原理如图所示,两个多孔电极均不参与电极反应.下列有关该燃料电池的说法错误的是(已知每摩尔电子所携带的电量为9.65×104C/mol)( )
固体氧化物燃料电池是一种新型的燃料电池,它是以固体氧化钇(Y2O3)、氧化锆(ZrO2)为解质,这种电解质在高温熔融状态下允许氧离子(O2-)在其间通过.某甲醇燃料电池的工作原理如图所示,两个多孔电极均不参与电极反应.下列有关该燃料电池的说法错误的是(已知每摩尔电子所携带的电量为9.65×104C/mol)( )| A. | 该燃料电池的负极反应式为CH3OH-6e-+3O2-═CO2↑+2H2O | |
| B. | 若有16g甲醇发生反应,该电池理论上提供的电量最多为2.895×105C | |
| C. | 氧气在负极发生还原反应 | |
| D. | O2-在电解质中的移动方向为:正极→负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
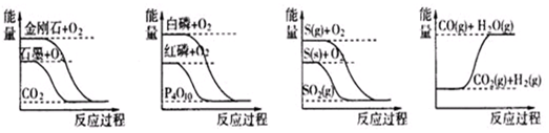
| A. | 石墨转变为金刚石是吸热反应 | |
| B. | 相同条件下,白磷比红磷稳定 | |
| C. | 相同条件下,等质量S(g)和S (s)的能量比较,S (s)能量较高 | |
| D. | CO(g)+H2O(g)=CO2(g)+H2 (g)是吸热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com