
| ||
| ||


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2014-2015甘肃省高二上学期期末考试化学试卷(解析版) 题型:计算题
(7分)已知25℃时KW=1.0×10-14 试计算:
(1)计算室温条件下0.1mol/LHCl溶液中由水电离的氢离子浓度.
(2)计算室温条件下0.01mol/LNaOH溶液的pH.
查看答案和解析>>
科目:高中化学 来源:2014-2015甘肃省高二上学期期末考试化学试卷(解析版) 题型:选择题
已知Ksp(AgCl)=1.8×10—10,Ksp(AgI)=1.5×10—16 ,Ksp(AgBr)=7.7×10—13,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是
A.AgCl>AgI> AgBr B.AgCl> AgBr>AgI
C.AgBr >AgCl>AgI D.AgBr >AgI>AgCl
查看答案和解析>>
科目:高中化学 来源:2014-2015甘肃省高二上学期期末考试化学试卷(解析版) 题型:选择题
下列有关电解池的说法正确的是
A.在电解池中与外接电源负极相连的电极是阳极
B.电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为2∶1
C.电解氯化铜溶液时,在阴极上有气体生成
D.电解稀硫酸溶液,实质上是电解水,故溶液pH不变
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省高二上学期期中化学(理)试卷(解析版) 题型:选择题
用已被部分氧化的金属屑A制备某工业常用盐C的步骤如下:
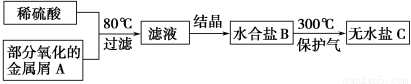
将C溶于水,向其中滴入NaOH溶液,出现白色沉淀,后逐渐变为红褐色,下列判断正确的是
A.过滤所得的残渣中一定没有金属A
B.滤液可能是CuSO4溶液或MgSO4溶液
C.水合盐B可能是FeSO4·7H2O
D.无水盐C可能是Fe2(SO4)3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com