
| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
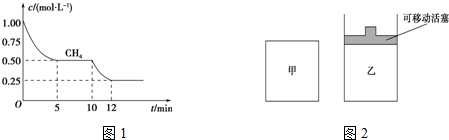
分析 (1)根据V=$\frac{△c}{△t}$求出CH4的化学反应速率,然后根据反应速率之比等于化学计量数之比,求出H2的化学反应速率;根据图象可知化学反应速率加快,化学平衡正向移动;
(2)①当可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质物质的量、物质的量浓度、百分含量以及由此引起的一系列物理量不变;
②由方程式反应反应向体积增大的方向进行,且甲的压强不乙大,以此判断;
(3)根据盖斯定律可知,①-②可得反应③,再利用Q与K的关系判断反应进行的方向,从而确定正逆反应速率的关系.
解答 解:(1)CH4的化学反应速率为V=$\frac{△c}{△t}$=$\frac{0.5mol/L}{5min}$=0.1mol/(L•min),根据反应速率之比等于化学计量数之比,H2的化学反应速率为0.3mol/(L•min),根据图象可知化学反应速率加快,化学平衡正向移动,根据外界条件对化学反应速率的影响和对化学平衡的影响,可用升高温度或充入水蒸气来达到目的,
故答案为:0.3mol/(L•min);升高温度或充入水蒸气;
(2)①a.生成CH4的速率是生成CO的速率的2倍,正逆反应速率不等,不能得到平衡状态,故错误;
b.反应前后体积不等,则容器内压强保持不变,可说明达到平衡状态,故正确;
c.气体质量不变,容器体积不变,则无论是否达到怕状态,容器内气体的密度都保持不变,故错误;
d.容器内各气体的浓度保持不变,可说明达到平衡状态,故正确.
故答案为:bd;
②a.反应向体积增大的方向移动,甲体积不变,压强增大,乙保持恒压,则甲的压强大,反应速率较大,化学反应速率:v (甲)>v (乙),故正确;
b.甲的压强较大,则增大压强平衡逆向移动,甲中甲烷的转化率较小,甲烷的转化率:α(甲)<α(乙),故正确;
c.由a分析可知甲的压强较大,故错误.
故答案为:ab;
(3)根据盖斯定律可知,①-②可得反应③,则△H3=+206.1kJ/mol-(+247.3kJ/mol)=-41.2kJ/mol,
800℃时,反应③的K=1.0时,正逆反应速率相等,化学平衡不移动;
由表格中的数据可知,气体的体积相同,则物质的量与浓度成正比,Q=$\frac{2.0×2.0}{0.5×8.5}$<K=1.0,该反应向正反应方向移动,则正反应速率大于逆反应速率,即选a,
故答案为:-41.2 kJ/mol;a.
点评 本题考查化学平衡计算、化学平衡影响因素、化学平衡状态判断等知识点,为高频考点,侧重考查学生分析判断及计算能力,只有反应前后改变的物理量才能作为平衡状态的判断依据,注意浓度商与化学平衡常数判断反应平衡移动方向的方法,题目难度中等.


科目:高中化学 来源: 题型:解答题

| 弱酸 | HClO2 | HF | H2CO3 | H2S |
| Ka/mol•L-1 | 1×10-2 | 6.3×10-4 | K1=4.30×10-7 K2=5.60×10-11 | K1=9.1×10-8 K2=l.1×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤⑥ | B. | ①②⑤⑥ | C. | ①②③⑤ | D. | ①②③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(PCl3)/mol | 4 | 2.8 | 2 | 1 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 热化学方程式 | 化学平衡常数 |
| ① | CO(g)+2H2(g)?CH3OH(g)△H1 | K1 |
| ② | 2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-24kJ/mol | K2 |
| ③ | CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41kJ/mol | K3 |
| 化学键 | H-H | C≡O | C-O | H-O | C-H |
| E/(kJ/mol) | 436 | 1076 | 343 | 465 | 413 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它们都具有放射性 | |
| B. | 尽管它们结构不同,但它们的化学性质相同 | |
| C. | 它们互为同分异构体 | |
| D. | 它们的原子最外层均为8电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4:9:24:14:28 | B. | 1:2:5:3:6 | C. | 8:9:12:10:20 | D. | l:l:l:l:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1)(2) | B. | (1)(3) | C. | (1) | D. | (3)(4) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com