
在基态多电子原子中,关于核外电子能量的叙述错误的是( )
A.最易失去的电子能量最高 B.电离能最小的电子能量最高
C.p轨道电子能量一定高于s轨道电子能量 D.在离核最近区域内运动的电子能量最低
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:
已知X的最高价氧化物对应的水化物化学式为H2XO3,Y是地壳中含量最高的元素,则XY2由固态变为气态所需克服的微粒间作用力是________;氢元素、X、Y的原子可共同形成多种分子,写出其中一种能形成同种分子间氢键的物质名称______。
★ ★★
查看答案和解析>>
科目:高中化学 来源: 题型:
用“元素符号”填空(前20号元素)
(1)主族序数与周期数相同的元素有________。
(2)主族序数是周期数2倍的元素有________,3倍的元素有________。
(3)周期数是主族序数2倍的元素有________,3倍的元素有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B在D中充分燃烧能生成其最高价化合物BD2。E+与D2-具有相同的电子数。A在F中燃烧,产物溶于水得到一种强酸。回答下列问题:
(1)A在周期表中的位置是________________,写出一种工业制备单质F的离子方程式________________________________________________________________________。
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为__________,其水溶液与F单质反应的化学方程式为_______________________________________
________________________________________________________________________;
在产物中加入少量KI,反应后加入CCl4并振荡,有机层显________色。
查看答案和解析>>
科目:高中化学 来源: 题型:
几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径(×10-10 m) | 1.86 | 0.99 | 1.43 | 1.60 | 0.75 | 0.74 | |
| 主要化合价 | 最高正价 | +1 | +7 | +3 | +2 | +5 | — |
| 最低负价 | — | -1 | — | — | -3 | -2 |
下列说法中正确的是( )
A.X、Z、R的最高价氧化物的水化物之间可两两相互反应
B.元素X和Q形成的化合物中不可能含有共价键
C.X、Y、M的单质分别与水反应,Y最剧烈
D.Y的氢化物的水溶液可用于雕刻玻璃
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下表信息,判断以下叙述正确的是( )
部分短周期元素的原子半径及主要化合价
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
A.氢化物的沸点为H2T<H2R B.单质与稀盐酸反应的速率为L<Q
C.M与T形成的化合物具有两性 D.L2+与R2-的核外电子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
NO分子因污染空气而臭名昭著。近年来,发现少量的NO在生物体内许多组织中存在,它有扩张血管、免疫、增强记忆的功能,成为当前生命科学的研究的热点,NO亦被称为“明星分子”。请回答下列问题:
(1)NO对环境的危害在于________(填以下项目的编号)。
A.破坏臭氧层 B.高温下能使一些金属被氧化
C.造成酸雨 D.与人体血红蛋白结合
(2)在含Cu+的酶的活化中心中,亚硝酸根离子可转化为NO,写出Cu+和亚硝酸根离子在酸性水溶液中反应的离子方程式:_________________________ _______________________________________________。
(3)在常温下,使NO气体压缩到100个大气压,在一个体积固定的容器里加热到50 ℃,发现气体的压力迅速下降,压力降至略小于原压力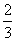 就不再改变,已知其中一种产物为N2O,写出上述变化的化学方程式:________________ ______________________________________________________________。
就不再改变,已知其中一种产物为N2O,写出上述变化的化学方程式:________________ ______________________________________________________________。
(4)解释变化(3)中为什么最后的气体总压力小于原压力的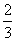 ?
?
_______________________________________________________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学上常用燃烧法确定有机物的组成。这种方法是在电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成。下图所示装置是用燃烧法确定有机物分子式常用的装置。

回答下列问题:
(1)产生的氧气按从左到右流向,所选装置各导管的连接顺序是_________________。
(2)C装置中浓H2SO4的作用是_______________________________________。
(3)D装置中MnO2的作用是________________________________________。
(4)燃烧管中CuO的作用是________________________________________。
(5)若准确称取0.90 g样品(只含C、H、O三种元素中的两种或三种),经充分燃烧后,A管质量增加1.32 g,B管质量增加0.54 g,则该有机物的最简式为___________________________。
(6)要确定该有机物的分子式,还要___________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com