
可确认发生了化学平衡移动的是( )
|
| A. | 化学反应速率发生了改变 |
|
| B. | 有气态物质参加的可逆反应达到平衡后,改变了压强 |
|
| C. | 由于某一条件的改变,使平衡混合物中各组分的浓度发生了不同程度的改变 |
|
| D. | 可逆反应达到平衡后,使用催化剂 |
考点:
化学平衡状态的判断;化学平衡的影响因素.
专题:
化学平衡专题.
分析:
可根据化学平衡移动的因素以及可以反应的类型来综合分析.
解答:
解:A.化学反应速率发生改变,未必能说明化学平衡发生了移动,当正反应速率与逆反应速率仍然相等时,化学平衡不会发生移动;当正反应速率与逆反应速率不相等时,化学平衡就会发生移动,故A错误;
B.对于气体总体积反应前后不变的可逆反应(如I2+H2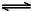 2HI)来说,无论是否建立平衡,其总物质的量即压强都不会发生变化;对于气体总体积反应前后不等的可逆反应(如2SO2+O2
2HI)来说,无论是否建立平衡,其总物质的量即压强都不会发生变化;对于气体总体积反应前后不等的可逆反应(如2SO2+O2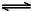 2SO3)来说,建立化学平衡状态时,总物质的量要与初始时的总物质的量不等,故压强要改变,故B错误;
2SO3)来说,建立化学平衡状态时,总物质的量要与初始时的总物质的量不等,故压强要改变,故B错误;
C.当平衡混合物各组分的浓度发生不同程度的变化时,就说明化学平衡向某个方向(正反应方向或逆反应方向)进行,即化学平衡发生了移动,故C正确.值得补充的是,当平衡混合物各组分的浓度发生同等程度的变化时,化学平衡未必发生移动,如对于I2+H2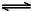 2HI来说,当增大加强减小体积时,就不会发生化学平衡的移动,故C正确;
2HI来说,当增大加强减小体积时,就不会发生化学平衡的移动,故C正确;
D.催化剂只能同等程度地改变正反应速率和逆反应速率,当一个可逆反应建立化学平衡状态后,加入催化剂,正反应速率仍然等于逆反应速率,化学平衡不会发生移动,故D错误;
故选C.
点评:
本题要求要能灵活运用影响化学平衡的因素来分思考问题,是对基础知识灵活运用的考查,要求学习时一定要记住并能深刻理解.


科目:高中化学 来源: 题型:
写出下列反应的离子方程式或化学方程式
(1)Ba(OH)2与H2SO4反应:(离子方程式) ;
(2)Fe与HCl反应:(离子方程式) ;
(3)Al与HCl溶液反应:(化学方程式) .
查看答案和解析>>
科目:高中化学 来源: 题型:
在不同条件下分别测得2SO2+O2⇌2SO3的化学反应速率,其中表示该反应进行最快的是( )
|
| A. | υ(SO2)=4 mol/(L•min) | B. | υ(O2)=0.1 mol/(L•s) |
|
| C. | υ(O2)=3mol/(L•min ) | D. | υ(SO2)=0.1 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:
某反应过程中体系的能量变化如图所示,下列说法错误的是( )
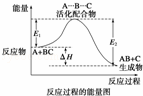
|
| A. | 反应过程可表示为 |
|
| B. | E1为反应物的平均能量与过渡态的能量差,称为正反应的活化能 |
|
| C. | 正反应的热效应为△H=E1﹣E2<0,所以正反应为放热反应 |
|
| D. | 此图中逆反应的热效应△H=E1﹣E2<0,所以逆反应为放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
将0.1mol•L﹣1醋酸溶液加水稀释,下列说法正确的是( )
|
| A. | 溶液中c(H+)和c(OH﹣)都减小 | B. | 溶液中c(H+)增大 |
|
| C. | 醋酸电离平衡向左移动 | D. | 溶液的pH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某酸HX的稀溶液和某碱YOH的稀溶液的物质的量浓度相等,两溶液混合后,溶液的PH大于7,表中判断合理的是( )
| 编号 | HX | YOH | 溶液的体积关系 |
| ① | 强酸 | 强碱 | V(HX)=V(YOH) |
| ② | 强酸 | 强碱 | V(HX)<V(YOH) |
| ③ | 强酸 | 弱碱 | V(HX)=V(YOH) |
| ④ | 弱酸 | 强碱 | V(HX)=V(YOH) |
|
| A. | ①③ | B. | ②③ | C. | ①④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应2SO2(g)+O2(g)⇌2SO3(g)△H<0,向某体积恒定的密闭容器中按体积比2:1充入SO2和O2,在一定条件下发生反应.下图是某物理量(Y)随时间(t)变化的示意图(图中T表示温度),Y可以是( )

|
| A. | SO2的转化率 | B. | 混合气体的密度 |
|
| C. | 密闭容器内的压强 | D. | O2的体积分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列几种氢键:①O—H…O、②N—H…N、③F—H…F、④O—H…N,按氢键从强到弱的顺序正确的是
| A.③>①>④>② | B.①>②>③>④ |
| C.③>②>①>④ | D.①>④>③>② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com