
 .
. .
.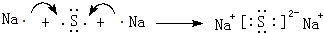
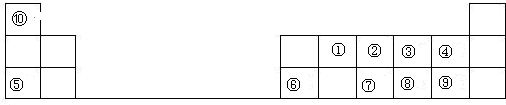
分析 根据元素在周期表中位置,可知①为C、②为N、③为O、④为F、⑤为Na、⑥为Al、⑦为P、⑧为S、⑨为Cl、⑩为H.
(1)③代表O元素,原子核外有8个电子,有2个电子层,各层电子数为2、6;
(2)非金属性越强,其气态氢化物越稳定;
(3)非金属性越强,最高价氧化物对应水化物的酸性越强;
(4)①的最高正价与③组成的化合物为CO2,分子中C原子与O原子之间形成2对共用电子对;
(5)同周期自左到右原子半径逐渐减小,同主族自上而下原子半径逐渐增大;
(6)③与⑤形成的常见的两种化合物为Na2O、Na2O2;
(7)⑤、⑥两种元素的最高价氧化物的水化物分别为NaOH、Al(OH)3,二者反应生成偏铝酸钠与水;
(8)⑤和⑧形成化合物为Na2S,由钠离子与硫离子构成,用Na原子、S原子电子式表示其形成;
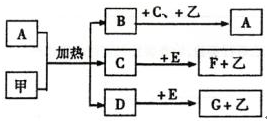
(9)甲是常见的黑色固体单质,可为生产生活提供热能,可知甲是C,甲与A的浓溶液反应生成B、C、D,B是无色有刺激性气味的气体,是主要的大气污染物之一,C是一种无色液体是水,则A为浓硫酸、B为SO2气体,C为H2O,D为CO2.二氧化硫和氧气和水反应生成硫酸,故乙为O2,水、二氧化碳均与E反应生成氧气,说明E为Na2O2,则F为NaOH,G为Na2CO3.
解答 解:根据元素在周期表中位置,可知①为C、②为N、③为O、④为F、⑤为Na、⑥为Al、⑦为P、⑧为S、⑨为Cl、⑩为H.
(1)③代表O元素,原子核外有8个电子,有2个电子层,各层电子数为2、6,原子结构示意图为: ,故答案为:
,故答案为: ;
;
(2)同周期自左而右非金属性增强、同主族自上而下非金属性减弱,故O、F、P、S中F元素非金属性最强,非金属性越强,其气态氢化物越稳定,故HF最稳定,故答案为:HF;
(3)非金属性Cl>S,非金属性越强,最高价氧化物对应水化物的酸性越强,故酸性:HClO4>H2SO4,
故答案为:HClO4;H2SO4;
(4)①的最高正价与③组成的化合物为CO2,分子中C原子与O原子之间形成2对共用电子对,电子式为 ,故答案为:
,故答案为: ;
;
(5)同周期自左到右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,故原子半径:Na>Al>F,故答案为:Na>Al>F;
(6)③与⑤形成的常见的两种化合物为Na2O、Na2O2,前者只含有离子键,后者含有离子键、共价键,故答案为:离子键;离子键、共价键;
(7)⑤、⑥两种元素的最高价氧化物的水化物分别为NaOH、Al(OH)3,二者反应生成偏铝酸钠与水,反应方程式为:NaOH+Al(OH)3=NaAlO2+2H2O,故答案为:NaOH+Al(OH)3=NaAlO2+2H2O;
(8)⑤和⑧形成化合物为Na2S,由钠离子与硫离子构成,用Na原子、S原子电子式表示其形成为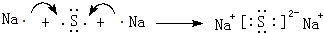 ,
,
故答案为: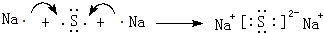 ;
;
(9)甲是常见的黑色固体单质,可为生产生活提供热能,可知甲是C,甲与A的浓溶液反应生成B、C、D,B是无色有刺激性气味的气体,是主要的大气污染物之一,C是一种无色液体是水,则A为浓硫酸、B为SO2气体,C为H2O,D为CO2.二氧化硫和氧气和水反应生成硫酸,故乙为O2,水、二氧化碳均与E反应生成氧气,说明E为Na2O2,则F为NaOH,G为Na2CO3.
①由上述分析可知,A为H2SO4,G为Na2CO3,故答案为:H2SO4;Na2CO3;
②A+甲的反应方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
C+E的反应方程式为:2Na2O2+2H2O=4NaOH+O2↑,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;2Na2O2+2H2O=4NaOH+O2↑.
点评 本题考查元素周期表与元素周期律、无机物的推断等,关键是熟练掌握元素周期表的结构推断元素,需要学生熟练掌握元素化合物的性质,是对学生综合能力的考查,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 19gH3O+共用的电子对数为2NA | |
| B. | 34gD2O2所含电子数为18NA | |
| C. | 1mol羟基(-16OH) 所含中子数为8NA | |
| D. | D16OD、T16OH共10g,所含中子数各为0.25NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 负极,被氧化 | B. | 正极,被还原 | C. | 负极,被还原 | D. | 正极,被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com