
【题目】2020年爆发的新冠肺炎让漂白粉及漂白液的销量大增。请回答下面的问题:
(1)工业上常将氯气制成漂白粉,而不是制成次氯酸的原因是______________________,制漂白粉的化学方程式是________
(2)下列物质露置在空气中会变质,在变化过程中既有非氧化还原反应发生,又有氧化还原反应发生的是________。
A.生石灰 B.漂白粉C.NaOH D.Na2SO3
(3)写出下列两个化学方程式。
①漂白粉+稀盐酸:__________
②漂白粉+浓盐酸:_______________________
(4)用贮存很久的漂白粉与浓盐酸反应制得的氯气中,可能含有的杂质气体是_____(填序号)。
①HCl ②O2 ③CO2 ④H2O(g)
【答案】漂白粉比HClO稳定,且便于贮存和运输 2Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O B Ca(ClO)2+2HCl=CaCl2+HClO Ca(ClO)2+4HCl(浓)= CaCl2+2Cl2![]() +2H2O ①③④
+2H2O ①③④
【解析】
(1)次氯酸不稳定,根据化学反应原理,写漂白粉制备方程式;
(2)根据变质过程,判断反应类型;
(3)稀盐酸显酸性;浓盐酸具有还原性;
(4)漂白粉久置,会有碳酸钙生成,同时浓盐酸具有挥发性,据此作答。
(1)次氯酸不稳定,易分解,漂白粉比HClO稳定,且便于贮存和运输;漂白粉由氯气和氢氧化钙反应制的,化学反应方程式为:2Ca(OH)2+2Cl2===Ca(ClO)2+CaCl2+2H2O,故答案为:漂白粉比HClO稳定,且便于贮存和运输;2Ca(OH)2+2Cl2===Ca(ClO)2+CaCl2+2H2O;
(2) A.生石灰与二氧化碳反应,生成碳酸钙,只有非氧化还原反应,故不符合题意;
B.漂白粉与二氧化碳反应生成次氯酸,属于非氧化还原反应,次氯酸见光分解,属于氧化还原反应,故符合题意;
C.NaOH与二氧化碳反应,生成碳酸钠,只有非氧化还原反应,故不符合题;
D.Na2SO3与氧气反应,生成硫酸钠,只有氧化还原反应,故不符合题意;
故答案为:B;
(3)稀盐酸显酸性,与漂白粉反应生成次氯酸,方程式为:Ca(ClO)2+2HCl===CaCl2+HClO;浓盐酸具有还原性,与漂白粉反应生成氯气,方程式为:Ca(ClO)2+4HCl(浓)=== CaCl2+2Cl2![]() +2H2O,故答案为:Ca(ClO)2+2HCl===CaCl2+HClO;Ca(ClO)2+4HCl(浓)=== CaCl2+2Cl2
+2H2O,故答案为:Ca(ClO)2+2HCl===CaCl2+HClO;Ca(ClO)2+4HCl(浓)=== CaCl2+2Cl2![]() +2H2O;
+2H2O;
(4)漂白粉久置,会有碳酸钙生成,碳酸钙与盐酸反应,生成二氧化碳和水,同时浓盐酸具有挥发性,可能含有的杂质气体二氧化碳、水蒸汽和HCl,故答案为:①③④。


科目:高中化学 来源: 题型:
【题目】非金属单质A经如图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题:
![]()
(1)若A在常温下为固体单质,B是能使品红溶液褪色的有刺激性气味的无色气体。
①写出B→C的化学方程式________________________________________。
②写出D+铜→B的化学方程式____________________________________。
(2)若A在常温下为气体单质,将装满气体C的试管倒扣在水槽中,溶液最终充满试管容积的![]() ,另外
,另外![]() 容积为无色气体。
容积为无色气体。
①A、C的化学式分别是:A____________;C___________。
②D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的离子方程式____。
(3)若A在常温下为非金属气态氢化物,B遇到空气变成红棕色。写出实验室制取A气体的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含ⅥA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)已知H2O2的结构如图:

H2O2分子不是直线形的,两个H原子犹如在半展开的书的两面纸上,书页角为93°52′,而两个O—H键与O—O键的夹角均为96°52′。根据该结构写出H2O2分子的电子式______。估计它难溶于CS2,简要说明原因:________________。
(2)O、S、Se原子的第一电离能由大到小的顺序为____________________。
(3)H2Se的酸性比H2S_____(填“强”或“弱”)。气态SeO3分子的立体构型为______,SeO32-离子中Se的杂化方式为______。
(4)硒化锌的晶胞结构如图所示,硒离子的配位数是____,若晶胞参数为d pm,则硒化锌的密度为______ g·cm-3。(不需要化简,1 m=109 nm=1012 pm)。
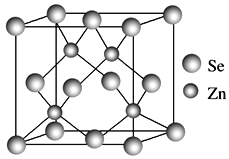
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用NOx+NH3![]() N2+H2O,使NOx转化为无毒的N2,现有NO、NO2的混合气体3.0 L,可与3.5 L相同状况的NH3恰好完全反应,全部转化为N2,则在原混合气体中NO和NO2的物质的量之比是()
N2+H2O,使NOx转化为无毒的N2,现有NO、NO2的混合气体3.0 L,可与3.5 L相同状况的NH3恰好完全反应,全部转化为N2,则在原混合气体中NO和NO2的物质的量之比是()
A.1∶3B.2∶1
C.3∶1D.1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,物质X2SO4的饱和溶液密度为ρg·mL-1,c(X+)=cmol·L-1 ,溶质 的质量分数为a% ,溶质的摩尔质量为Mg·mol-1,溶解度为Sg,下列表达式正确的是( )
A. c=2000ρa/M B. a%=c/2000ρ
C. M=1000ρa%/c D. S=100cM/(2000ρ-cM)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普通锌锰电池筒内无机物主要成分为MnO2、NH4Cl、ZnCl2等。某研究小组探究废于电池内的黑色固体并回收利用时,进行如图所示实验。下列有关实验的叙述正确的是
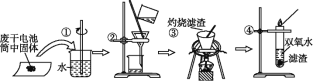
A. 操作①中玻璃棒的作用是转移固体 B. 操作②为过滤,得到的滤液显碱性
C. 操作③中盛放药品的仪器是坩埚 D. 操作④的目的是除去滤渣中的杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应,2NO2(g)(红棕色)![]() N2O4(g)(无色),如图所示。
N2O4(g)(无色),如图所示。

(1)曲线____(填“X”或“Y”)表示NO2的物质的量随时间的变化曲线,
(2)若降低温度,则v(正)____,v(逆)____.(填“加快"或“减慢"或“不变”)
(3)在0到3min中内X的反应速率为____
(4)达到反应限度时X的转化率为____,注:物质的转化率= ![]() ×100%
×100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增加,m、n、p是由这些元素组成的二元化合物,r是一种气态单质,n为淡黄色粉末,相关物质转化关系如图所示。室温下,0. 0lmol/L的s溶液pH为12,X的质子数是W与Z的质子数之和的一半。下列说法正确的是
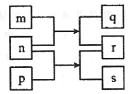
A.原子半径:W<X<Y
B.简单氢化物沸点:Z<X<Y
C.n、s中均含有离子键和共价键
D.q溶于水时温度升高,证明其水解过程放热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,则这个碳原子被称为“手性碳原子”,凡含有手性碳原子的物质一定具有光学活性,如物质 有光学活性,发生下列反应后生成的有机物无光学活性的是( )
有光学活性,发生下列反应后生成的有机物无光学活性的是( )
①与甲酸发生酯化反应 ②与NaOH溶液反应 ③与银氨溶液作用 ④在催化剂存在下与氢气作用
A. ①③B. ②④
C. ①④D. ②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com