
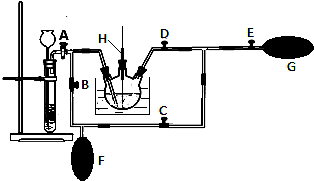
分析 (1)熔融固体物质需要在坩埚内加热,加热熔融物含有碱性KOH应用铁坩埚;
(2)①该操作的目的是将气囊F中的二氧化碳排出,压入K2MnO4溶液中再次反应;
②根据“K2MnO4溶液显绿色”可知,如果该歧化反应结束,则反应后的溶液不会显示绿色;
(3)蒸发溶液获得晶体时不能蒸干,避免固体飞溅;高锰酸钾在温度较高时容易分解,需要低温下烘干;
(4)根据n=cV计算出25mL待测液消耗的草酸钠的物质的量,再根据反应方程式计算出25mL待测液中含有高锰酸钾的物质的量,从而计算出样品中含有高锰酸钾的物质的量,然后根据m=nM计算出高锰酸钾的质量,最后计算出纯度;待测液被蒸馏水稀释后浓度减小,测定的样品中含有的高锰酸钾物质的量减小,纯度减小.
解答 解:(1)熔融固体物质需要在坩埚内加热,加热熔融物中含有碱性KOH,瓷坩埚中含有二氧化硅,二氧化硅能够与氢氧化钾反应,所以应用铁坩埚,所以④正确,
故答案为:④;
(2)①待气囊F收集到较多气体时,需要将气囊F中二氧化碳排出到热K2MnO4溶液中,所以需要关闭A、C,打开B、D、E,轻轻挤压气囊F,从而使CO2气体缓缓地压入K2MnO4溶液中再次反应,未反应的CO2气体又被收集在气囊G中,
故答案为:A、C;B、D、E;
②由于K2MnO4溶液显绿色,所以用玻璃棒蘸取三颈烧瓶内的溶液点在滤纸上,若滤纸上只有紫红色痕迹,无绿色痕迹,表明反应已歧化完全,
故答案为:用玻璃棒蘸取三颈烧瓶内的溶液点在滤纸上,若滤纸上只有紫红色痕迹,无绿色痕迹,表明反应已歧化完全;
(3)蒸发溶液获得高锰酸钾时不能蒸干,避免固体飞溅及高锰酸钾的分解,所以应该加热到溶液表面出现晶膜时停止加热,并且应采用低温烘干的方法来干燥产品,避免高锰酸钾晶体受热发生分解,
故答案为:溶液表面出现晶膜为止;高锰酸钾晶体受热易分解;
(4)50mL 0.1000mol•L-1草酸钠标准溶液中含有草酸钠的物质的量为:0.1mol/L×0.05L=0.005mol,根据反应2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O可知,消耗0.005mol草酸钠需要消耗高锰酸根离子的物质的量为:0.005mol×$\frac{5}{2}$=0.002mol,
500mL配制的样品溶液中含有高锰酸根离子的物质的量为:0.002mol×$\frac{500mL}{25mL}$=0.04mol,
则样品中含有高锰酸钾的质量为:0.04mol×158g•mol-1=6.32g,
则高锰酸钾产品的纯度为:$\frac{6.32g}{7.245g}$×100%=87.23%;
若移液管用蒸馏水洗净后没有用待测液润洗或烘干,则导致待测液浓度减小,滴定时消耗的标准液体积偏小,测定结果偏小,
故答案为:87.23%;偏小.
点评 本题通过高锰酸钾的制备,考查了物质制备实验方案的设计,题目难度中等,涉及了样品中纯度计算、化学实验基本操作方法、物质制备原理等知识,明确物质制备原理及流程为解答本题的关键,试题充分考查了学生的分析、理解能力及化学实验、化学计算的能力.


科目:高中化学 来源: 题型:选择题
| A. | NO2被还原 | B. | CO是氧化剂 | C. | CO发生还原反应 | D. | NO2失去电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量金属钠保存在煤油里 | |
| B. | 液溴应保存在棕色磨口玻璃塞的试剂瓶中,并加少量水进行水封 | |
| C. | 为防止氧化,FeSO4溶液存放在加有少量铜粉的试剂瓶中 | |
| D. | 硝酸应装在棕色瓶中密封避光保存 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 5种 | C. | 6种 | D. | 9种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 四种元素的原子半径从大到小的顺序是:M>Z>Y>X | |
| B. | 元素X、Z可形成某种化合物,其分子内既含极性键又含非极性键 | |
| C. | 化合物YO2、ZO2都能和氢氧化钠溶液反应,均属于酸性氧化物 | |
| D. | 金属M制品具有较强的抗腐蚀能力,说明M元素的金属活动性较差 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 化学键 | C=O | C-O | C-H | H-H | O-H |
| 键能/kJ•mol-1 | 745 | 351 | 415 | 436 | 462 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com