
”¾ĢāÄæ”æI”¢Ģś¼°Ęä»ÆŗĻĪļÓėÉś²ś”¢Éś»ī¹ŲĻµĆÜĒŠ”£
(1)ÓŅĶ¼ŹĒŹµŃéŹŅŃŠ¾æŗ£Ė®¶ŌĢśÕ¢²»Ķ¬²æĪ»øÆŹ“ĒéæöµÄĘŹĆęŹ¾ŅāĶ¼.

¢ŁøƵē»ÆøÆŹ“³ĘĪŖ___________”£
¢ŚĶ¼ÖŠA”¢B”¢C”¢DĖÄøöĒųÓņ£¬Éś³ÉĢśŠā×ī¶ąµÄŹĒ___________ (Ģī×ÖÄø)”£
(2)¼ŗÖŖ£ŗFe(s)+O2(g)=FeO(s)H=-272.0kJmol-1
C(s)+O2(g)=CO2(g)£»”÷H=-393.5kJmol-1
2C(s)+O2(g)=2CO(g)£»”÷H=-221kJmol-1
ŌņøßĀÆĮ¶Ģś¹ż³ĢÖŠFeO(s)+CO![]() Fe(S)+CO2(g) ”÷H=____________”£
Fe(S)+CO2(g) ”÷H=____________”£
II”¢¼×“¼ŹĒŅ»ÖÖÖŲŅŖµÄ»Æ¹¤ŌĮĻŗĶŠĀŠĶČ¼ĮĻ”£ĻĀĶ¼ŹĒ¼×“¼Č¼ĮĻµē³Ų¹¤×÷µÄŹ¾ŅāĶ¼£¬ĘäÖŠA”¢B”¢D¾łĪŖŹÆÄ«µē¼«£¬CĪŖĶµē¼«£®¹¤×÷Ņ»¶ĪŹ±¼äŗ󣬶ĻæŖK£¬“ĖŹ±A£¬BĮ½¼«ÉĻ²śÉśµÄĘųĢåĢå»żĻąĶ¬”£


(1)¼×ÖŠøŗ¼«µÄµē¼«·“Ó¦Ź½ĪŖ_________________”£
(2)ŅŅÖŠA¼«Īö³öµÄĘųĢåŌŚ±ź×¼×“æöĻĀµÄĢå»żĪŖ_____________”£
(3)±ū×°ÖĆČÜŅŗÖŠ½šŹōŃōĄė×ÓµÄĪļÖŹµÄĮæÓė×ŖŅʵē×ÓµÄĪļÖŹµÄĮæ±ä»Æ¹ŲĻµÓŅĶ¼£¬ŌņĶ¼ÖŠ¢ŚĻß±ķŹ¾µÄŹĒ_____________Ąė×ӵıä»Æ£»·“Ó¦½įŹųŗó£¬ŅŖŹ¹±ū×°ÖĆÖŠ½šŹōŃōĄė×ÓĒ”ŗĆĶźČ«³Įµķ£¬ŠčŅŖ_________________mL 5£®0 molL-1 NaOHČÜŅŗ”£
”¾“š°ø”æ
I.(1)¢ŁĪüŃõøÆŹ“£»¢ŚB£»(2)-11KJ”¤mol-1£»
II.¢ÅCH3OHØD6e-£«8OH-=CO32-£«6H2O£»¢Ę2.24L£»¢ĒFe2£«£»280£»
”¾½āĪö”æ
ŹŌĢā·ÖĪö£ŗI.(1)¢Łŗ£Ė®ČÜŅŗ²»ŹĒ½ĻĒæĖįŠŌČÜŅŗ£¬ŌņøÖĢś·¢ÉśĪüŃõøÆŹ“£¬¹Ź“š°øĪŖ£ŗĪüŃõøÆŹ“£»¢ŚøÖĢś½Ó“„æÕĘų”¢Ė®Ź±·¢ÉśµÄĪüŃõøÆŹ“µÄ³Ģ¶Č×ī“ó£¬Éś³ÉĢśŠā×ī¶ą£¬ĖłŅŌBÉś³ÉĢśŠā×ī¶ą£¬¹Ź“š°øĪŖ£ŗB£»
(2)ŅŃÖŖ£ŗ¢ŁFe(s)+![]() O2(g)ØTFeO(s)”÷H=-272kJmol-1£¬
O2(g)ØTFeO(s)”÷H=-272kJmol-1£¬
¢ŚC(s)+O2(g)ØTCO2(g)”÷H=-393.5kJmol-1£¬
¢Ū2C(s)+O2(g)ØT2CO(g)”÷H=-221kJmol-1£¬
øł¾ŻøĒĖ¹¶ØĀÉ£¬¢Ś-¢Ū”Į![]() -¢ŁæÉµĆ£ŗ
-¢ŁæÉµĆ£ŗ
FeO(s)+CO(g)=Fe(s)+CO2(g)£¬Ōņ
”÷H=-393.5kJmol-1-![]() ”Į(-221kJmol-1)-(-272kJmol-1)=-11kJmol-1£¬¹Ź“š°øĪŖ£ŗ-11 kJmol-1£»
”Į(-221kJmol-1)-(-272kJmol-1)=-11kJmol-1£¬¹Ź“š°øĪŖ£ŗ-11 kJmol-1£»
¢ņ£®(1)¼×“¼Č¼ĮĻµē³ŲŹĒŌµē³Ų·“Ó¦£¬¼×“¼ŌŚøŗ¼«Ź§µē×Ó·¢ÉśŃõ»Æ·“Ó¦£¬µē¼«·“Ó¦ĪŖ£ŗCH3OH-6e-+8OH-=CO32-+6H2O£¬¹Ź“š°øĪŖ£ŗCH3OH-6e-+8OH-=CO32-+6H2O£»
(2)¹¤×÷Ņ»¶ĪŹ±¼äŗ󣬶ĻæŖK£¬“ĖŹ±A”¢BĮ½¼«ÉĻ²śÉśµÄĘųĢåĢå»żĻąĶ¬£¬·ÖĪöµē¼«·“Ó¦£¬BĪŖŅõ¼«£¬ČÜŅŗÖŠĶĄė×ÓĪö³ö£¬ĒāĄė×ӵƵ½µē×ÓÉś³ÉĒāĘų£¬ÉčÉś³ÉĘųĢåĪļÖŹµÄĮæĪŖX£¬ČÜŅŗÖŠĶĄė×ÓĪļÖŹµÄĮæĪŖ0.1mol£¬µē¼«·“Ó¦ĪŖ£ŗ
Cu2++2e-=Cu£¬
0.1mol 0.2mol
2H++2e-=H2”ü£¬
2x x
Aµē¼«ĪŖŃō¼«£¬ČÜŅŗÖŠµÄĒāŃõøłĄė×ÓŹ§µē×ÓÉś³ÉŃõĘų£¬µē¼«·“Ó¦ĪŖ£ŗ
4OH--4e-=2H2O+O2”ü£¬
4x x
øł¾ŻµĆŹ§µē×ÓŹŲŗćµĆµ½0.2+2x=4x£¬x=0.1mol£¬ŅŅÖŠA¼«Īö³öµÄĘųĢåŹĒŃõĘų£¬ĪļÖŹµÄĮæĪŖ0.1mol£¬ŌŚ±ź×¼×“æöĻĀµÄĢå»żĪŖ2.24L£¬¹Ź“š°øĪŖ£ŗ2.24L£»
(3)øł¾Ż×ŖŅʵē×ÓµÄĪļÖŹµÄĮæŗĶ½šŹōŃōĄė×ÓµÄĪļÖŹµÄĮæµÄ±ä»Æ£¬æÉÖŖ£¬ĶĄė×Ó“ÓĪŽŌö¶ą£¬ĢśĄė×ÓĪļÖŹµÄĮæ¼õŠ”£¬ŃĒĢśĄė×ÓŌö¼Ó£¬¹Ź¢ŁĪŖFe3+£¬¢ŚĪŖFe2+£¬¢ŪĪŖCu2+£¬ÓÉĶ¼æÉÖŖµē×Ó×ŖŅĘĪŖ0.4mol£¬Éś³ÉCu2+ĪļÖŹµÄĮæĪŖ0.2mol£¬Ņõ¼«µē¼«·“Ó¦Fe3++e-=Fe2+£¬·“Ó¦½įŹųŗó£¬ČÜŅŗÖŠÓŠFe2+ĪŖ0.5mol£¬Cu2+ĪŖ0.2mol£¬ĖłŅŌŠčŅŖ¼ÓČėNaOHČÜŅŗ0.5”Į2+0.2”Į2=1.4mol£¬ĖłŅŌĖłŠčNaOHČÜŅŗµÄĢå»żĪŖ![]() =0.28L=280mL£¬¹Ź“š°øĪŖ£ŗFe2+£»280”£
=0.28L=280mL£¬¹Ź“š°øĪŖ£ŗFe2+£»280”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÅØ¶Č¾łĪŖ0.10 mol/L”¢Ģå»ż¾łĪŖV0µÄMOHŗĶROHČÜŅŗ£¬·Ö±š¼ÓĖ®Ļ”ŹĶÖĮĢå»żV£¬pHĖę![]() µÄ±ä»ÆČēĶ¼ĖłŹ¾£¬ĻĀĮŠŠšŹö“ķĪóµÄŹĒ( )
µÄ±ä»ÆČēĶ¼ĖłŹ¾£¬ĻĀĮŠŠšŹö“ķĪóµÄŹĒ( )

A£®MOHµÄ¼īŠŌĒæÓŚROHµÄ¼īŠŌ
B£®ROHµÄµēĄė³Ģ¶Č£ŗbµć“óÓŚaµć
C£®ČōĮ½ČÜŅŗĪŽĻŽĻ”ŹĶ£¬ŌņĖüĆĒµÄc(OH-)ĻąµČ
D£®µ±lg![]() =2Ź±£¬ČōĮ½ČÜŅŗĶ¬Ź±ÉżøßĪĀ¶Č£¬Ōņ
=2Ź±£¬ČōĮ½ČÜŅŗĶ¬Ź±ÉżøßĪĀ¶Č£¬Ōņ ![]() Ōö“ó
Ōö“ó
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚ1”Į105 PaŗĶ298 KŹ±£¬½«1 molĘųĢ¬AB·Ö×Ó·ÖĄė³ÉĘųĢ¬AŌ×ÓŗĶBŌ×ÓĖłŠčŅŖµÄÄÜĮæ³ĘĪŖ¼üÄÜ(kJ”¤mol£1)”£ĻĀĆęŹĒŅ»Š©¹²¼Ū¼üµÄ¼üÄÜ£ŗ(ŅŃÖŖ°±·Ö×ÓÖŠÓŠČżøöµČ¼ŪµÄµŖĒā¹²¼Ū¼ü)
¹²¼Ū¼ü | H-H¼ü | NČżN¼ü | N-H¼ü |
¼üÄÜ(kJ”¤mol£1) | 436 | 945 | 391 |
¹¤ŅµŗĻ³É°±µÄ»Æѧ·½³ĢŹ½£ŗN2£«3H2![]() 2NH3£¬
2NH3£¬
¶ĻæŖ1 mol N2ÖŠµÄ»Æѧ¼üŠč_____ (Ģī”°ĪüŹÕ”±»ņ”°·Å³ö”±)945 kJÄÜĮ棬ŠĪ³É2 mol NH3ÖŠµÄ»Æѧ¼üŠč_____ (Ģī”°ĪüŹÕ”±»ņ”°·Å³ö”±) ________ kJÄÜĮ棻
ŌŚ298 KŹ±£¬Č”1 mol N2ŗĶ3 mol H2·ÅČėŅ»ĆܱÕČŻĘ÷ÖŠ£¬ŌŚ“߻ƼĮ“ęŌŚĻĀ½ųŠŠ·“Ó¦”£ĄķĀŪÉĻ·Å³ö»ņĪüŹÕµÄČČĮæĪŖQ1£¬ŌņQ1ĪŖ____________ kJ”£
øł¾ŻÉĻ±ķÖŠµÄŹż¾ŻÅŠ¶Ļ¹¤ŅµŗĻ³É°±µÄ·“Ó¦ŹĒ______(Ģī”°ĪüČČ”±»ņ”°·ÅČČ”±)·“Ó¦”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ“ÓÕĮæĘÖ²ĪļÖ¦Ņ¶ĢįČ”µÄ¾«ÓĶÖŠŗ¬ÓŠ¼×”¢ŅŅĮ½Öֳɷ֣ŗ
![]()
![]()
£Ø1£©¢ŁÓĆĖįŠŌøßĆĢĖį¼ŲČÜŅŗ¼ģŃé¼×ŗĶŅŅÖŠŗ¬ÓŠĢ¼Ģ¼Ė«¼ü£¬·½°øŹĒ·ńæÉŠŠ Ģī”°æÉŠŠ”±»ņ”°²»æÉŠŠ”±£©”£
¢ŚĒėŠ“³ö¼×µÄŅ»ÖÖÄÜĶ¬Ź±Āś×ćĻĀĮŠ3øöĢõ¼žµÄĶ¬·ÖŅģ¹¹ĢåµÄ½į¹¹¼ņŹ½ ”£
a£®±½»·ÉĻÓŠĮ½øö²»Ķ¬µÄČ”“ś»ł
b£®ÄÜÓėBr2µÄCCl4ČÜŅŗ·¢Éś¼Ó³É·“Ó¦
c£®ÓöFeCl3ČÜŅŗ³ŹĻÖ×ĻÉ«
£Ø2£©Óɼ××Ŗ»ÆĪŖŅŅµÄ¹ż³ĢĪŖ(ŅŃĀŌČ„ĪŽ¹Ų²śĪļ)£ŗ

²½Öč¢ńµÄ·“Ó¦ĄąŠĶĪŖ £¬YµÄ½į¹¹¼ņŹ½ £¬Éč¼Ę²½Öč¢ńµÄÄæµÄŹĒ ”£
£Ø3£©1 molŅŅ×ī¶ąæÉÓė mol H2·¢Éś¼Ó³É·“Ó¦”£
£Ø4£©Š“³öŅŅÓėŠĀÖĘCu(OH)2Šü×ĒŅŗ·“Ó¦µÄ»Æѧ·½³ĢŹ½ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”潚Źō¾§ĢåµÄĻĀĮŠŠŌÖŹÖŠ£¬²»ÄÜÓĆ½šŹō¾§Ģå½į¹¹¼ÓŅŌ½āŹĶµÄŹĒ
A. Ņ×µ¼µē B. Ņ×µ¼ČČ C. ÓŠŃÓÕ¹ŠŌ D. Ņ׊āŹ“
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æij»ÆѧµēŌ“µÄ¹¤×÷ŌĄķČēĶ¼”£ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ( )
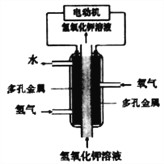
A. ²ÉÓƶąæ×½šŹō×÷µē¼«æÉŌö“óµē¼«½Ó“„Ć껿£¬Ģįø߶ŌĘųĢåµÄĪüø½ÄÜĮ¦
B. ĶØH2µÄµē¼«×÷øŗ¼«£¬·¢ÉśŃõ»Æ·“Ó¦
C. ĶØO2µÄµē¼«·¢ÉśµÄµē¼«·“Ó¦£ŗO2+4e-+4H+=2H2O
D. øƵē³Ų¹¤×÷Ź±·¢ÉśµÄÖ÷ŅŖÄÜĮæ×Ŗ»ÆŠĪŹ½ĪŖ»ÆѧÄÜ×Ŗ»ÆĪŖµēÄÜŗĶČČÄÜ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÓĆ0.1000mol”¤L-1NaOHČÜŅŗµĪ¶ØĪ“ÖŖÅØ¶ČµÄŃĪĖį£¬Ń”ÓĆ·ÓĢŖĪŖÖøŹ¾¼Į£¬Ōģ³É²ā¶Ø½į¹ūĘ«øßµÄŌŅņæÉÄÜŹĒ
A£®Ź¢×°“ż²āŅŗµÄ׶ŠĪĘæÓĆÕōĮóĖ®Ļ“¹ż£¬Ć»ÓĆ“ż²āŅŗČóĻ“
B£®ĖįŹ½µĪ¶Ø¹ÜŌŚŹ¹ÓĆĒ°Ī“ÓĆ“ż²āŅŗŃĪĖįČóĻ“
C£®µĪ¶ØĒ°¼īŹ½µĪ¶Ø¹Ü¼ā×ģÖŠÓŠĘųÅŻ£¬µĪ¶ØŗóĘųÅŻĻūŹ§
D£®µĪ¶ØĒ°¶ĮŹżĘ½ŹÓ£¬µĪ¶ØÖÕµć¶ĮŹżŹ±ø©ŹÓ¼īŹ½µĪ¶Ø¹ÜµÄæĢ¶Č
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ¶ŌÓŠ»śĪļ½į¹¹µÄĆčŹö“ķĪóµÄŹĒ
A. ¼×ĶéÓėĀČĘųµÄ»ģŗĻĘųĢåŌŚ¹āÕÕĻĀÉś³ÉµÄÓŠ»ś»ÆŗĻĪļ¾łĪŽĶ¬·ÖŅģ¹¹Ģå
B. ×é³ÉĪŖC7H16µÄĶéĢžÖŠ½öÄÜÓÉŅ»ÖÖµ„Ļ©Ģž¼ÓĒā¶ųÖʵƵÄÓŠ2ÖÖ
C. ijĢžµÄ½į¹¹¼ņŹ½æɱķŹ¾ĪŖ![]() £ØĢ¼Ō×ÓŹż”Ü10)”£ŅŃÖŖ·Ö×ÓÖŠÓŠĮ½ÖÖ»Æѧ»·¾³²»Ķ¬µÄĒāŌ×Ó£¬ĒŅŹżÄæÖ®±ČĪŖ3”Ć2£¬ŌņøĆĢžŅ»¶ØŹĒ±½µÄĶ¬ĻµĪļ
£ØĢ¼Ō×ÓŹż”Ü10)”£ŅŃÖŖ·Ö×ÓÖŠÓŠĮ½ÖÖ»Æѧ»·¾³²»Ķ¬µÄĒāŌ×Ó£¬ĒŅŹżÄæÖ®±ČĪŖ3”Ć2£¬ŌņøĆĢžŅ»¶ØŹĒ±½µÄĶ¬ĻµĪļ
D. ŗ¬5øöĢ¼Ō×ÓµÄÓŠ»śĪļ£¬Ćæøö·Ö×ÓÖŠ×ī¶ąæÉŠĪ³É4øöC”ŖC¼ü
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚČŻ»ż¾łĪŖ500mlµÄI”¢II”¢IIIČżøöĆܱÕČŻĘ÷ÖŠ·Ö±š³äČėl molN2ŗĶ2.5 molH2£¬ČżøöČŻĘ÷µÄ·“Ó¦ĪĀ¶Č·Ö±šĪŖT1”¢T2”¢T3ĒŅŗć¶Ø²»±ä£¬ŌŚĘäĖūĢõ¼žĻąĶ¬µÄĒéæöĻĀ·¢Éś·“Ó¦N2(g)£«3H2(g) ![]() 2NH3(”÷H<0)”£ŹµŃé²āµĆ·“Ó¦¾ł½ųŠŠµ½t minŹ±N2µÄĢå»ż·ÖŹżČēĶ¼ĖłŹ¾”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
2NH3(”÷H<0)”£ŹµŃé²āµĆ·“Ó¦¾ł½ųŠŠµ½t minŹ±N2µÄĢå»ż·ÖŹżČēĶ¼ĖłŹ¾”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ

A£®µ±v(H2)=3v(N2)Ź±£¬æÉŅŌĖµĆ÷ČżøöČŻĘ÷ÖŠµÄ·“Ó¦“ļĘ½ŗāדĢ¬
B£®ŌŚt minŹ±£¬Ņ»¶Ø“ļ»ÆŃ§Ę½ŗāדĢ¬µÄŹĒ¢ņŗĶ¢ó
C£®ŌŚt minŹ±£¬²āµĆc(N2)=1mol/L£»ČōŌŚĻņIIIÖŠ³äČė1.5molN2ŗĶ1molNH3£¬H2µÄ×Ŗ»ÆĀŹ²»±ä
D£®ČżøöČŻĘ÷ÖŠµÄ·“Ó¦¾ł“ļµ½Ę½ŗāŗó£¬ČŻĘ÷IÖŠ»ģŗĻĘųĢåµÄĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæ×īŠ”
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com