
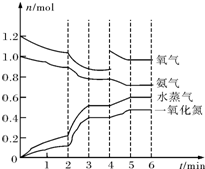
 在一密闭容器中,高温下发生下述反应(不考虑NO与氧气的反应):4NH3(g)+5O2(g)?4NO(g)+6H2O(g).容器中NH3、O2、NO、H2O四种物质的物质的量n(mol)随时间t(min)的变化曲线如图所示.反应进行至2min时,只改变了某一条件,使曲线发生变化,该条件可能是下述中的( )
在一密闭容器中,高温下发生下述反应(不考虑NO与氧气的反应):4NH3(g)+5O2(g)?4NO(g)+6H2O(g).容器中NH3、O2、NO、H2O四种物质的物质的量n(mol)随时间t(min)的变化曲线如图所示.反应进行至2min时,只改变了某一条件,使曲线发生变化,该条件可能是下述中的( )| A. | 充入了O2(g) | B. | 降低温度 | C. | 加了催化剂 | D. | 扩大了容器体积 |
科目:高中化学 来源: 题型:选择题
| A. | Cl元素的相对原子质量为37 | |
| B. | $\frac{1}{20}$mol的1H37Cl分子所含中子数约为6.02×1023 | |
| C. | 7.4 g的37Cl2气体的体积为2.24L | |
| D. | 37Cl2气体的摩尔质量为74g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢键是一种化学键 | |
| B. | 冰中存在氢键、液态氟化氢中不存在氢键 | |
| C. | H2O是一种非常稳定的化合物,这是由于氢键所致 | |
| D. | 氨气极易溶于水,重要的原因之一是由于氨分子与水分子之间能形成氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
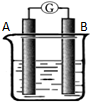 某研究性学习小组欲探究原电池的工作原理,按如图所示装置进行实验.
某研究性学习小组欲探究原电池的工作原理,按如图所示装置进行实验.| 序号 | A | B | 烧杯中的液体 |
| 1 | Mg | Al | 稀H2SO4 |
| 2 | Pt | Pt | NaOH溶液 |
| 3 | Pt | Pt | 熔融的Na2CO3 |
| 4 | Pb | PbO2 | 稀H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 标准状况下,22.4LH2的分子数为1NA | |
| B. | 0 5mol•L-1的MgCl2溶液,含有Cl数为1NA | |
| C. | 56g铁片投人足量的浓硫酸中生成1.5NA个SO2分子 | |
| D. | 常温常压下,14gN2含有分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓解度:碳酸氢钠>碳酸钠 | |
| B. | 热稳定性:碳酸钠<碳酸氢钠 | |
| C. | 等质量时与足量酸反应产气量:碳酸钠>碳酸氢钠 | |
| D. | 一定的条件下可以相互转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两个原子或多个原子之间的相互作用叫做共价键 | |
| B. | 阴、阳离子间通过静电引力而形成的化学键叫做离子键 | |
| C. | 分子晶体中一定含有共价键,离子晶体中一定含有离子键 | |
| D. | 氯化钠晶体中含有阳离子,氯化钠溶液中也含有阳离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
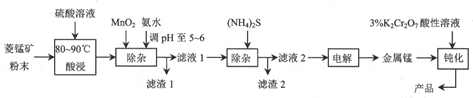
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com