
分析 (1)写出N的核外电子排布式,基态N原子有多少个核外电子就有几种不同的运动状态;根据排布式确定电子占据的最高能级;
(2)根据价层电子对互斥理论确定其空间构型,共价单键是σ键,共价双键中一个是σ键一个是π键,共价三键中一个σ键两个π键;
(3)(OCN)2和(SCN)2都是分子晶体,根据分子晶体溶沸点的比较方法进行分析;
(4)同一周期元素,元素的第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素,据此判断第一电离能大小顺序;根据价层电子对互斥理论确定其杂化轨道类型;
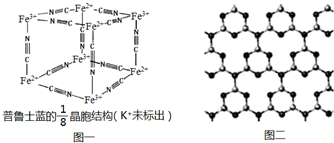
(5)利用均摊法计算普鲁士蓝化学式,根据化学式可知,普鲁士蓝含有离子键,属于离子晶体,根据普鲁士蓝晶胞结构计算1个普鲁士蓝晶胞的质量;
(6)每个C和周围4个N共用电子对,每个N和周围3个C共用电子对.
解答 解:(1)基态N原子的核外电子排布式为1s22s22p3,基态N原子核外有 7个电子,因此有7种运动状态不同的电子,电子占据的最高能级符号为2p;
故答案为,7;2p;
(2)氰分子(N≡C-C≡N)碳原子价层电子对个数=2+$\frac{1}{2}$(4-1×4)=2,C原子采取sp杂化,故空间结构为直线型,共价单键是σ键,共价双键中一个是σ键一个是π键,共价三键中一个σ键两个π键,所以含有σ键与π键个数之比=3:4,
故答案为:直线型;3:4;
(3)硫氰(SCN)2和(OCN)2的性质与卤素单质相似,它们被称为拟卤素,两者属于分子晶体,分子晶体结构相似,式量越大,范德华力较强,溶沸点越高,(SCN)2的相对分子量较大,范德华力较强,所以(SCN)2固体的熔点较高,
故答案为:(SCN)2较高,二者组成与结构相似,(SCN)2的相对分子量较大,范德华力较强;
(4)同一周期元素,元素的第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素,C、N、O元素处于同一周期且原子序数逐渐增大,N处于第VA族,所以第一电离能N>O>C,CN22?中C与N形成三键,N与N形成单键,中心C原子的价层电子对个数=2+$\frac{1}{2}$(4-1×3-1)=2,C原子采取sp杂化,
故答案为:N>O>C;sp;
(5)普鲁士蓝立方体结构中Fe3+离子的个数为:4×$\frac{1}{8}$=$\frac{1}{2}$,Fe2+离子的个数为:4×$\frac{1}{8}$=$\frac{1}{2}$,CN-离子的个数为:12×$\frac{1}{4}$=3,根据电荷守恒:N(K+)+N(Fe3+)×3+N(Fe2+)×2=N(CN-),得N(K+)=$\frac{1}{2}$,普鲁士蓝中 n(K+):n(Fe3+):n(Fe2+):n(CN-)=1:1:1:6,则其化学式为KFe2(CN)6,含有离子键、共价键、配位键,属于离子晶体,普鲁士蓝式量为307,普鲁士蓝的1/8晶胞结构含有Fe3+离子的个数为$\frac{1}{2}$,Fe2+离子的个数为$\frac{1}{2}$,所以1个普鲁士蓝晶胞的质量=$\frac{4×307}{{N}_{A}}$=$\frac{1228}{{N}_{A}}$,
故答案为:离子晶体;$\frac{1228}{{N}_{A}}$;
(6)由图可知一个N与三个C成键,一个C 与四个N成键,所以其化学式为:C3N4,
故答案为:C3N4.
点评 本题考查物质结构有关知识,掌握原子核外电子排布、杂化轨道理论的应用,晶体结构的解题技巧是解答关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | NH4+、Ba2+、Cl-、AlO2- | B. | SO42-、NO3-、Fe2+、Al3+ | ||
| C. | Cl-、SO32-、Na+、K+ | D. | Na+、K+、ClO-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/S | 0 | 1 | 2 | 3 | 4 | 5 |
| C(NO)(×10-4mol•L-1) | 10.0 | 4.05 | 2.50 | 1.50 | 1.00 | 1.00 |
| C(CO) (×10-3mol•L-1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 四种元素中原子半径最大的为Z | |
| B. | Y、Z、M的氢化物中,M的氢化物最稳定 | |
| C. | 四种元素最多可形成两种盐 | |
| D. | 由四种元素中的两种形成的相对分子质量最小的有机物不能发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
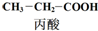 $→_{①}^{Cl_{2},红磷}$
$→_{①}^{Cl_{2},红磷}$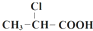 $→_{②}^{一定条件}$
$→_{②}^{一定条件}$ 下列说法正确的是( )
下列说法正确的是( )| A. | 步骤①、②分别是加成反应、取代反应 | B. | 蛋白质水解也可生成乳酸 | ||
| C. | 丙酸烃基上的二氯代物有2种 | D. | 乳酸与丙烯完全燃烧的产物相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
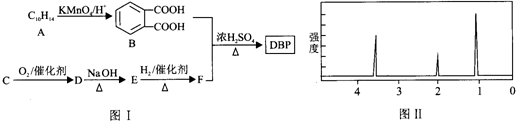
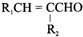 +H2O(R1、R2示氢原子或烃基)
+H2O(R1、R2示氢原子或烃基) .
.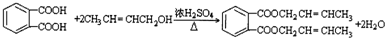 .
.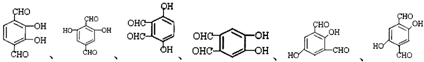 任意2种(填结构简式).
任意2种(填结构简式).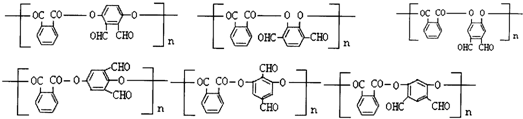 任意一种(填结构简式).
任意一种(填结构简式).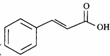 ) 的合成路线
) 的合成路线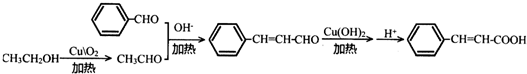 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 双氧水、高锰酸钾溶液可以完全灭活埃博拉病毒,其消毒原理与漂白粉消毒饮用水的原理相同 | |
| B. | 用乙醚从黄花蒿中提取青蒿素是利用了氧化还原反应原理 | |
| C. | 在某爆炸事故救援现场,消防员发现存放金属钠、电石、甲苯二异氰酸酯等化学品的仓库起火,应立即用泡沫灭火器将火扑灭 | |
| D. | 钢化玻璃、有机玻璃、防弹玻璃均属于硅酸盐材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
| 含量/mg•L-1 | 9360 | 83 | 160 | 1100 | 16000 | 1200 | 118 |
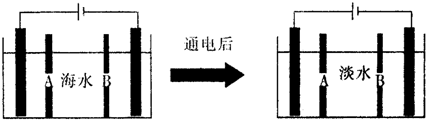
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com