
分析 ①Na2CO3、NaHCO3是强碱弱酸盐,碳酸根离子、碳酸氢根离子水解溶液显碱性,碳酸根离子水解程度大于碳酸氢根离子,溶液中氢氧根离子浓度越大;
②氯化铵溶液中铵根离子水解溶液显酸性,铵根离子浓度越大水解程度越小,溶液中氢离子浓度越大.
解答 解:①Na2CO3、NaHCO3是强碱弱酸盐,碳酸根离子、碳酸氢根离子水解溶液显碱性,碳酸根离子水解程度大于碳酸氢根离子,溶液中氢氧根离子浓度越大,溶液PH0.1mol•L-1Na2CO3溶液>0.1mol•L-1NaHCO3溶液,故答案为:>;
②氯化铵溶液中铵根离子水解溶液显酸性,铵根离子浓度越大水解程度越小,溶液中氢离子浓度越大,溶液PH越小,0.1mol•L-1NH4Cl溶液<0.01mol•L-1NH4Cl溶液,故答案为:<.
点评 本题考查了盐类水解原理、水解平衡影响因素的分析应用,掌握基础是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 向苯酚钠溶液中通入少量的SO2气体:C6H5O-+SO2+H2O→C6H5OH+HSO3- | |
| B. | 次氯酸钙溶液中通入过量二氧化碳:ClO-+H2O+CO2═HCO3-+HClO | |
| C. | 向NaHSO4溶液中滴加Ba(OH)2至溶液恰好呈现中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 用惰性电极电解MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2015年8月12号接近午夜时分,天津滨海新区一处集装箱码头发生爆炸.发生爆炸的是集装箱内的易燃易爆物品,爆炸火光震天,并产生巨大蘑菇云.
2015年8月12号接近午夜时分,天津滨海新区一处集装箱码头发生爆炸.发生爆炸的是集装箱内的易燃易爆物品,爆炸火光震天,并产生巨大蘑菇云.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 Na2CO3溶液中CO32-、HCO3-和H2CO3总数为0.1 NA | |
| B. | NaCl的沸点为1465℃,1500℃时气体摩尔体积是Vm,此状态下,3Vm L的氯化钠含有3 NA个共价键 | |
| C. | 25℃,1 L pH=1的稀硫酸中含有的H+数为0.1 NA | |
| D. | 1 mol Cu和足量稀硝酸反应产生$\frac{2}{3}$ NA个NO分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,1mol氦气含有的原子数为NA | |
| B. | 标准状况下,5.6L四氯化碳含有的分子数为0.25NA | |
| C. | 常温常压下,氧气和臭氧(O3)的混合物32g中含有NA个氧原子 | |
| D. | 物质的量浓度为1 mol•L-1的K2SO4溶液中,含2NA个K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如图所示.
氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如图所示. .
. .
.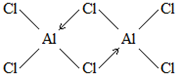 (标明配位键).
(标明配位键).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
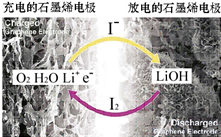 科学家开发出一种新型锂-氧电池,其能量密度极高,效率达到90%以上,电池中添加碘化锂(LiI)和微量水,工作原理如图所示,总反应为:O2+4LiI+2H2O$?_{充电}^{放电}$2I2+4LiOH对于该电池的下列说法不正确的是( )
科学家开发出一种新型锂-氧电池,其能量密度极高,效率达到90%以上,电池中添加碘化锂(LiI)和微量水,工作原理如图所示,总反应为:O2+4LiI+2H2O$?_{充电}^{放电}$2I2+4LiOH对于该电池的下列说法不正确的是( )| A. | 充电时阴极反应为LiOH+e-═Li+OH | |
| B. | 充电时Li+从阳极区移向阴极区 | |
| C. | 放电时正极反应为O2+2H2O+4Li++4e-═4LiOH | |
| D. | 放电时负极上I- 被氧化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com