
| A. | 该溶液中氢离子的浓度:c(H+)=1×10-11 mol/L | |
| B. | 0.1 mol/L氨水溶液与0.1 mol/L HCl溶液等体积混合后所得溶液中:c(NH4+)+c(H+)=c(Cl-)+c(OH-) | |
| C. | 0.1 mol/L的氨水溶液与0.05 mol/L H2SO4溶液等体积混合后所得溶液中:c(NH4+)+c(NH3•H2O)=2c(SO42-) | |
| D. | 浓度均为0.1 mol/L的NH3•H2O和NH4Cl溶液等体积混合后,若溶液呈碱性,则c(NH4+)>c(NH3•H2O)>c(Cl-)>c(OH-)>c(H+) |
分析 根据溶液中c(H+)与c(OH-)的比值结合溶液的离子积常数Kw计算出溶液的c(H+)和c(OH-),结合溶液中的电荷守恒和物料守恒分析.
解答 解:A.常温下,0.1mol/L氨水溶液中$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-8,Kw=c(H+)×c(OH-)=1×10-14,则溶液的c(H+)=1×10-11mol/L,故A正确;
B.0.1 mol/L氨水溶液与0.1 mol/L HCl溶液等体积混合后所得溶液溶质为氯化铵,由电荷守恒可知,c(NH4+)+c(H+)=c(Cl-)+c(OH-),故B正确;
C.0.1 mol/L的氨水溶液与0.05 mol/L H2SO4溶液等体积混合后所得溶液中溶质为(NH4)2SO4,由物料守恒可知c(NH4+)+c(NH3•H2O)=2c(SO42-),故C正确;
D.浓度均为0.1 mol/L的NH3•H2O和NH4Cl溶液等体积混合后,若溶液呈碱性,氨水的电离程度大于铵根离子的水解程度,c(NH3•H2O)<c(Cl-),所以c(NH4+)>c(Cl-)>c(NH3•H2O)>c(OH-)>c(H+),故D错误;
故选:D.
点评 本题考查酸碱混合后溶液pH的判断和溶液中守恒关系的应用,题目难度中等,本题的关键是根据溶液中c(H+)与c(OH-)的比值,结合溶液的离子积常数Kw计算出溶液的c(H+),注意把握溶液中的物料守恒和电荷守恒.


 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:实验题
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol•L-1FeCl3溶液 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
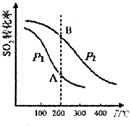 研究硫酸工业原理及含硫化合物的性质具有重要意义.
研究硫酸工业原理及含硫化合物的性质具有重要意义.| 气体 | SO2 | O2 | SO3 |
| 浓度(mol•L-1) | 0.4 | 1.2 | 1.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn(s)+CuSO4(aq)═ZnSO4(aq)+Cu(s)△H=-216 kJ•mol-1,则反应物总能量>生成物总能量 | |
| B. | 相同条件下,如果1 mol氢原子所具有的能量为E1,1 mol氢分子所具有的能量为E2,则2E1=E2 | |
| C. | 101 kPa时,2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1,则H2的燃烧热为571.6 kJ•mol-1 | |
| D. | H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,则含1 mol NaOH的氢氧化钠固体与含0.5 mol H2SO4的稀硫酸混合后放出57.3 kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
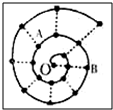 某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个弧线上的“•”代表一种元素,其中O点代表氢元素.下列说法中正确的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个弧线上的“•”代表一种元素,其中O点代表氢元素.下列说法中正确的是( )| A. | 离O点越远的元素越容易失去电子 | |
| B. | 虚线相连的元素处于同一周期 | |
| C. | B元素是图中原子半径最大的主族元素 | |
| D. | 元素O和A可形成多种化合物、和B不能形成化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油裂解能得到乙烯,乙烯是生产聚乙烯的原料 | |
| B. | 甲烷、苯都属于烃,都不存在同分异构体 | |
| C. | 点燃甲烷前一定要检验其纯度 | |
| D. | 煤干馏为化学变化,石油分馏是物理变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com