
| A. | 将28.4g Na2SO4溶于水配成1000mL溶液,溶液中c (Na+)的物质的量浓度为0.2mol/L | |
| B. | 80 mL 1 mol•L-1氯化钠溶液中的c (Na+)与40 mL 1 mol•L-1碳酸钠溶液中的c (Na+) 相等 | |
| C. | 0.5 mol•L-1NaCl和0.5mol•L-1Na2SO4两溶液相比较,Na+的物质的量之比为1:2 | |
| D. | 4 mol•L-1的NaCl溶液稀释成100 mL 0.2molL-1的NaCl溶液,需4 mol•L-1的NaCl溶液的体积为5.0mL |
分析 A.根据n=$\frac{n}{V}$计算出硫酸钠的物质的量,然后得出钠离子的物质的量,再根据c=$\frac{n}{V}$计算出溶液中钠离子的浓度;
B.1 mol•L-1氯化钠溶液中的c (Na+)=1mol/L,40 mL 1 mol•L-1碳酸钠溶液中的c (Na+)=2mol/L;
C.缺少溶液体积,无法计算溶液中钠离子的物质的量;
D.稀释过程中溶质氯化钠的物质的量不变,据此计算出需要浓氯化钠溶液的体积.
解答 解:A.28.4g Na2SO4的物质的量为:$\frac{28.4g}{142g/mol}$=0.2mol,0.2mol硫酸钠中含有0.4mol钠离子,则该溶液中c (Na+)的物质的量浓度为0.4mol/L,故A错误;
B.80 mL 1 mol•L-1氯化钠溶液中的c (Na+)=1mol/L,40 mL 1 mol•L-1碳酸钠溶液中的c (Na+)=2mol/L,两溶液中钠离子浓度不相等,故B错误;
C.没有告诉0.5 mol•L-1NaCl和0.5mol•L-1Na2SO4溶液的体积,无法计算溶液中钠离子的物质的量,故C错误;
D.4mol•L-1的NaCl溶液稀释成100 mL 0.2mol•L-1的NaCl溶液,稀释过程中氯化钠的物质的量不变,则需4 mol•L-1的NaCl溶液的体积为:$\frac{0.2mol/L×0.1L}{4mol/L}$=0.00L=5.0mL,故D正确;
故选D.
点评 本题考查了物质的量浓度的计算,题目难度中等,明确物质的量与物质的量浓度、摩尔质量之间的关系为解答关键,注意掌握物质的量浓度的概念及表达式,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 25℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA | |
| B. | 粗铜精炼时,当阳极质量减少6.4 g时,电路中转移的电子数一定不是0.2NA | |
| C. | 含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1NA | |
| D. | 200 mL 0.5 mol•L-1 Na2CO3溶液中,由于CO32-水解,所以阴离子的数目小于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑥ | B. | ①③④⑤ | C. | ①②③ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 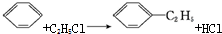 | B. | 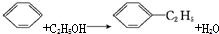 | ||
| C. | 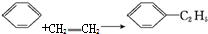 | D. | 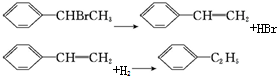 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
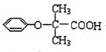
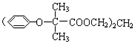 ,可用于降低血液中的胆固醇,该物质合成线路如图所示:
,可用于降低血液中的胆固醇,该物质合成线路如图所示: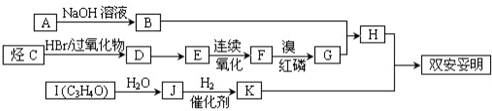
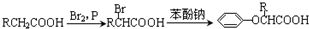
 .
. .
.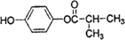 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨气通入醋酸溶液 CH3COOH+NH3═CH3COONH4 | |
| B. | 澄清的石灰水跟盐酸反应 H++OH-═H2O | |
| C. | 碳酸钡溶于醋酸 BaCO3+2H+═Ba2++H2O+CO2↑ | |
| D. | 金属钠跟水反应 Na+H2O═Na ++OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气:Na+、Ba2+、HSO3-、I- | B. | 二氧化碳:Ca2+、NO3-、Ba2+、Cl- | ||
| C. | 氨气:Fe3+、Al3+、Na+、NO3- | D. | 二氧化硫:Ba2+、K+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com