
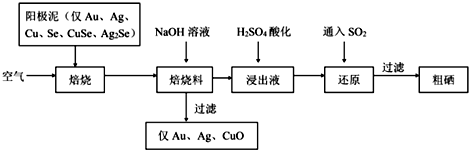
分析 阳极泥中含有Ag、Au、Cu、Se、CuSe、Ag2Se,在空气中焙烧得到的焙烧料中含SeO2,加入氢氧化钠溶液,过滤得到滤渣主要为Ag、Au、CuO,滤液浸出液中得到NaSeO3,加入硫酸酸化得到H2SeO3,通入SO2还原得粗硒,
(1)向浸出液中通入SO2“还原”得粗硒是利用二氧化硫的还原性还原亚硒酸为Se,二氧化硫被氧化为硫酸;
(2),加入硫酸将上一步得到的亚硒酸盐转化为亚硒酸,中和过量的氢氧化钠溶液;
(3)根据氧化剂的氧化性大于氧化产物的氧化性判断;
(4)Na2S2O3标准溶液显碱性,选择指示剂为淀粉溶液,滴入到最后一滴蓝色恰好消失且半分钟不变色;
(5)根据反应的方程式可知Se~SeO2~2I2~4Na2S2O3计算;
(6)Se蒸汽在氧气流中被氧化成SeO2,流入冷凝罐形成雪白色的SeO2粉末.
解答 解:阳极泥中含有Ag、Au、Cu、Se、CuSe、Ag2Se,在空气中焙烧得到的焙烧料中含SeO2,加入氢氧化钠溶液,过滤得到滤渣主要为Ag、Au、CuO,滤液浸出液中得到NaSeO3,加入硫酸酸化得到H2SeO3,通入SO2还原得粗硒,
(1)向浸出液中通入SO2“还原”得粗硒是利用二氧化硫的还原性还原亚硒酸为Se,二氧化硫被氧化为硫酸,反应的离子方程式为H2SeO3+2SO2+H2O=Se+4H++2SO42-,
故答案为:H2SeO3+2SO2+H2O=Se+4H++2SO42-;
(2)焙烧料加入氢氧化钠,反应后溶液呈碱性,加入硫酸,可将上一步得到的亚硒酸盐转化为亚硒酸,中和过量的氢氧化钠溶液,
故答案为:将上一步得到的亚硒酸盐转化为亚硒酸,中和过量的氢氧化钠溶液;
(3)浓硫酸和Se反应可生成SeO2,可知氧化性H2SO4(浓)>SeO2,SeO2可与二氧化硫反应生成Se,可氧化性SeO2>SO2,可知氧化性H2SO4(浓)>SeO2>SO2,流程中加入的硫酸在氧化还原反应中会从新生成,可以循化使用,
故答案为:H2SO4(浓)>SeO2>SO2;H2SO4;
(4)Na2S2O3标准溶液显碱性应用碱式滴定管盛放,待测溶液用锥形瓶盛放,通过用Na2S2O3溶液滴定反应中生成的l2来计算硒的含量,所以选择指示剂为淀粉溶液,滴入到最后一滴蓝色恰好消失且半分钟不变色;
故答案为:碱式;淀粉溶液;最后一滴,蓝色恰好消失且半分钟内不变色;
(5)根据反应的方程式可知Se~SeO2~2I2~4Na2S2O3,消耗的n(Na2S2O3)=0.2000 mol/L×0.030L=0.006mol,根据关系式计算样品中n(Se)=0.006mol×$\frac{1}{4}$=0.0015mol,故Se的质量为0.0015mol×79g/mol=0.1185g,所以样品中Se的质量分数为$\frac{0.1185g}{0.1200g}$×100%=98.75%,
故答案为:98.75%;
(6)依据粗Se加热时,Se蒸汽在氧气流中被氧化成SeO2,流入冷凝罐形成雪白色的SeO2粉末分析可知,氧气主要是起到氧化剂和载体的主要作用;
故答案为:氧化剂、载运体.
点评 本题以工艺流程图为知识背景,为高频考点,侧重于学生的分析、实验和计算能力的考查,同时考查了氧化还原反应、离子检验、基本实验操作、物质纯度的测定及技术等,题目涉及的知识点较多,考查学生对知识的综合应用能力,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | Fe和Cl2恰好完全反应 | B. | 生成99gFeCl3 | ||
| C. | 会有9.33gFe过量 | D. | 会有17.75gCl2过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 方程式 | 结论 |
| A | 2AgI(s)+S2-(aq)?Ag2S(s)+2I-(aq) | 溶解度:Ag2S>AgI |
| B | C(s.石墨)═C(s.金刚石)△H>0 | 稳定性:金刚石>石墨 |
| C | 3Fe2++NO${\;}_{3}^{-}$+10H+═3Fe3++3H2O+NH${\;}_{4}^{+}$ | 还原性:Fe2+>NH${\;}_{4}^{+}$ |
| D | 2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3;Fe+S$\frac{\underline{\;加热\;}}{\;}$FeS | 氧化性:Cl2>S |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁和氯化铁溶液反应:Fe3++Fe═2Fe2+ | |
| B. | 醋酸和氢氧化钠溶液反应:CH3COOH+OH-═CH3COO-+H2O | |
| C. | 实验室用MnO2和浓盐酸制取Cl2:MnO2+2H++2Cl-═Mn2++Cl2↑+H2O | |
| D. | 氢氧化铁和盐酸反应:H++OH-═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 电浮选凝聚法是工业上采用的一种污水处理方法,即保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3胶体,Fe(OH)3胶体具有吸附作用,可吸附水中的污物而使其沉淀下来,起到净水的作用,其原理如图所示.下列说法正确的是( )
电浮选凝聚法是工业上采用的一种污水处理方法,即保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3胶体,Fe(OH)3胶体具有吸附作用,可吸附水中的污物而使其沉淀下来,起到净水的作用,其原理如图所示.下列说法正确的是( )| A. | 石墨电极上发生氧化反应 | |
| B. | 根据图示,物质A为CO2 | |
| C. | 为增强污水的导电能力,可向污水中加入适量乙醇 | |
| D. | 甲烷燃料电池中CO32-向空气一极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com