
KMnO4和浓盐酸反应也会生成氯气。其变化可表述为:
![]()
(1)请完成该化学方程式并配平(未知物化学式和化学计量数填入框内)
(2)浓盐酸在反应中显示出来的性质是 (填写编号)
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
科目:高中化学 来源: 题型:阅读理解
| ||
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:
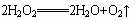
Ⅰ.上图是一套实验室制气装置,某课外活动小组欲利用这套装置快速制取氧气和氯化氢气体,供选用的试剂有:A.浓H2SO4,B.浓盐酸,C.食盐,D.MnO2,?E.H2O2(aq)?,F.KClO3,G.KMnO4溶液,试完成下列问题:?
(1)若要快速制备少量氧气,应选择___________(选项编号)。?
(2)若要快速制备少量HCl,应选择___________(选项编号)。?
Ⅱ.已知H2O2(aq)有酸性,也有漂白作用,它在MnO2的催化下可以加速分解:?
![]()
某学生查阅资料后指出Na2O2与水反应时,先生成NaOH和H2O2:?
![]()
此反应放出的热量,促使H2O2缓慢分解,生成O2:?
![]()
该过程的总反应方程式即为:?
![]()
该同学所在的课外兴趣小组欲验证他的以上认识,实验室提供了下列仪器和?药品:??
仪器:试管、胶头滴管、烧杯、药匙、镊子?
药品:Na2O2、水、酚酞试液、石蕊试液、MnO2?
假设你是该课外活动小组的成员,请你简述实验过程,并写出实验现象和实验结论。
查看答案和解析>>
科目:高中化学 来源: 题型:
本题包括以下两小题。?
![]()
Ⅰ.右图是一套实验室制气装置,某课外活动小组欲利用这套装置快速制取氧气和氯化氢气体,供选用的试剂有:A.浓H2SO4,B.浓盐酸,C.食盐,D.MnO2,?E.H2O2(aq)?,F.KClO3,G.KMnO4溶液,试完成下列问题:?
(1)若要快速制备少量氧气,应选择___________(选项编号)。?
(2)若要快速制备少量HCl,应选择___________(选项编号)。?
Ⅱ.已知H2O2(aq)有酸性,也有漂白作用,它在MnO2的催化下可以加速分解:?
①2H2O2====2H2O+O2↑?
某学生查阅资料后指出Na2O2与水反应时,先生成NaOH和H2O2:?
②Na2O2+2H2O====2NaOH+H2O2?
此反应放出的热量,促使H2O2缓慢分解,生成O2:?
③2H2O2====2H2O+O2↑?
该过程的总反应方程式即为:?
④2Na2O2+2H2O====4NaOH+O2↑?
该同学所在的课外兴趣小组欲验证他的以上认识,实验室提供了下列仪器和?药品:??
仪器:试管、胶头滴管、烧杯、药匙、镊子?
药品:Na2O2、水、酚酞试液、石蕊试液、MnO2?
假设你是该课外活动小组的成员,请你简述实验过程,并写出实验现象和实验?结论。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
某实验小组欲测定KMnO4的分解率α,但加热前忘记称量KMnO4的质量。面对此情况,甲同学采用下述方法:在加热时,利用浓盐酸与KMnO4受热部分分解后所得的固体混合物反应产生的Cl2被碱石灰吸收,通过碱石灰增重来计算KMnO4的分解率α。(与热的浓盐酸反应时,固体混合物中的Mn元素均被还原成Mn2+)

取KMnO4受热部分分解后所得的固体混合物mg进行实验,请从k@s^5*u上图中选用所需的仪器(可重复选用)组成一套反应装置,其它固、液试剂自选。(其中某些连接和固定仪器用的
玻璃管、胶管、铁夹、铁架台及加热装置、打气筒等均略去)
(1)在反应发生前,为了消除装置内空气中酸性气体的影响,须用打气筒向装置内鼓入一定量的空气。请你在下表中填写完成本实验时各装置的连接次序及药品。
| 各装置连接次序 | A | C | C | |||
| 对应的药品 | d:浓盐酸 e:固体混合物 | 碱石灰 | 碱石灰 |
(2)k@s^5*u上述高锰酸钾受热部分分解后所得固体混合物中K2MnO4与MnO2物质的量之比是 。
(3)当A装置内反应结束后,关闭分液漏斗活塞,打开止水夹k,再一次用打气筒向装置内鼓入一定量空气,其目的是 。
(4)若测得碱石灰增重ng。为了计算KMnO4的分解率α,该同学采用方法如下:设原mg的固体混合物中KMnO4及MnO2的物质的量分别为x、y,依据实验数据m及n,可列出三个含x、y、α的等式,请你写出这三个等式。(注意:等式中不用带单位)
仅含m、x、y的等式①:m= 。
仅含 n、x、y的等式②:n= 。
仅含α、x、y的等式③:α= 。
(5)另一同学设计更为简单的方法(无须化学反应)也可测定KMnO4的分解率α。
该同学的方法是:称取一定量KMnO4受热部分分解后所得的固体混合物,置于盛有适量蒸馏水的烧杯中,充分搅拌,再进行“一系列实验操作”并记录实验数据,最后经计算,即可得出KMnO4的分解率α。该同学的“一系列实验操作”是指 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年浙江省宁波市十校联考理综化学试卷(解析版) 题型:选择题
硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得:Na2SO3 + S  Na2S2O3,常温下溶液中析出晶体为Na2S2O3·5H2O。Na2S2O3·5H2O于40~45℃熔化,48℃分解;Na2S2O3 易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线如右图所示。
Na2S2O3,常温下溶液中析出晶体为Na2S2O3·5H2O。Na2S2O3·5H2O于40~45℃熔化,48℃分解;Na2S2O3 易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线如右图所示。

Ⅰ.现按如下方法制备Na2S2O3·5H2O:
将硫化钠和碳酸钠按反应要求比例一并放入三颈烧瓶中,注入150mL蒸馏水使其溶解,在分液漏斗中,注入浓盐酸,在装置2中加入亚硫酸钠固体,并按下图安装好装置。
(1)仪器2的名称为 ,
装置6中可放入 。
A.BaCl2溶液 B.浓H2SO4 C.酸性KMnO4溶液 D.NaOH溶液

(2)打开分液漏斗活塞,注入浓盐酸使反应产生的二氧化硫气体较均匀的通入Na2S和Na2CO3的混合溶液中,并用磁力搅拌器搅动并加热,反应原理为:
①Na2CO3+SO2 =Na2SO3+CO2
②Na2S+SO2+H2O=Na2SO3+H2S
③2H2S+SO2=3S↓+2H2O
④Na2SO3+S Na2S2O3
Na2S2O3
总反应为:2Na2S+Na2CO3+4SO2= 3Na2S2O3+CO2
随着二氧化硫气体的通入,看到溶液中有大量浅黄色固体析出,继续通二氧化硫气体,反应约半小时。当溶液中pH接近或不小于7时,即可停止通气和加热。溶液PH要控制不小于7理由是
(用离子方程式表示)。
Ⅱ.分离Na2S2O3·5H2O并标定溶液的浓度:

(1)为减少产品的损失,操作①为 ,操作②是抽滤洗涤干燥,其中洗涤操作是用
(填试剂)作洗涤剂。
(2)蒸发浓缩滤液直至溶液呈微黄色浑浊为止,蒸发时为什么要控制温度不宜过高
(3)称取一定质量的产品配置成硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:用分析天平准
确称取基准物质K2Cr2O7(摩尔质量294g/mol)0.5880克。平均分成3份分别放入3个锥形瓶中,加
水配成溶液,并加入过量的KI并酸化,发生下列反应:6I-+Cr2O72-+14H+=3I2+2Cr3++7H2O,再加入几滴
淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应:I2+2S2O32-=2I-+S4O62-,滴定终点的现象为
三次消耗Na2S2O3溶液的平均体积为20.00mL,则所标定的硫代硫酸钠溶液
的浓度为 mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com