
【题目】实验室区别下列物质选用的试剂(括号中的为试剂,必要时可加热)不正确的是( )
A. 苯和己烯(溴水)B. 矿物油和植物油(NaOH溶液)
C. 淀粉和纤维素(碘水)D. 硝基苯和CCl4(水)
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 2.24L甲烷气体中碳氢键的数目为0.4NA
B. lmolSO2与足量的O2反应,转移的电子数为2NA
C. 1 mol·L-1CH3COOH 与1 mol·L-1CH3COONa 溶液等体积混合,溶液中CH3COOH 和CH3COO-的总数为2NA
D. 7.8g乙炔与苯的混合物完全燃烧所消耗的O2分子数为0.75NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂用电解法处理含有SO2的尾气,其装置如图所示(电极材料均为惰性电极)。下列说法不正确的是

A. 电极a连接的是电源的正极
B. 若电路中转移0.03mole-,则离子交换膜左侧溶液中增加0.03mol离子
C. 图中的离子交换膜是阳离子交换膜
D. 阴极的电极反应式为2HSO3-+2e-+2H+==S2O42-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:AgOH很不稳定,易分解生成Ag2O(黑色)。溶液X中可能含有下列离子:Ag+,NH4+、Fe3+、SO42-、SO32-、Cl-中的几种离子。为了确定其组成,某同学进行了如下实验:
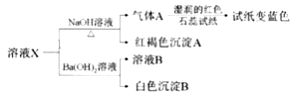
下列说法不正确的是( )
A. 溶液X与NaOH反应生成红褐色沉淀A,可推测该溶液中不存在SO32-
B. 溶液X中一定不含Ag+
C. 溶液X中一定存在NH4+、Fe3+、SO42-
D. 取少量溶液B,加入AgNO3溶液,若有沉淀产生,则有Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的转化在给定条件下能实现的是 ( )
①Al2O3![]() NaAlO2(aq)
NaAlO2(aq)![]() Al(OH)3
Al(OH)3
②S![]() SO3
SO3![]() H2SO4
H2SO4
③饱和NaCl(aq)![]() NaHCO3
NaHCO3![]() Na2CO3
Na2CO3
④Fe2O3![]() FeCl3(aq)
FeCl3(aq)![]() 无水FeCl3
无水FeCl3
⑤MgCl2(aq)![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO
A. ①③⑤ B. ②③④ C. ②④⑤ D. ①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2广泛用于造纸工业、污水处理等,其漂白能力是漂白粉的4~5倍,工业上用C1O2气体制NaClO2的工艺流程如下:
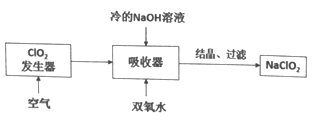
己知:NaClO2饱和溶液在低于38℃时析出NaC1O2·3H2O,高于38℃时析出NaClO2
下列说法不正确的是
A. 吸收器中生成NaClO2的离子方程式:2ClO2+2OH-+H2O2=2ClO2-+O2+2H2O
B. 流程中的结晶、过滤操作应该是蒸发结晶、趁热过滤
C. 提高吸收器中的反应温度可以提高反应速率,也提高反应物的利用率
D. 发生器中反应结束后,向其中通入一定量空气的目的是驱赶出ClO2,使其被充分吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用一定方法可除去下列物质所含的少量杂质(括号内为杂质),其中所加物质能达到除杂目的的是
A. Cl2(HCl)用NaOH溶液 B. Na2CO3(NaHCO3)用HCl溶液
C. NaCl溶液(I2)用CCl4 D. FeCl2(FeCl3)通入Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】直接排放含SO2的烟气会形成酸雨,危害环境。某化学兴趣小组进行如下有关SO2性质和含量测定的探究活动。
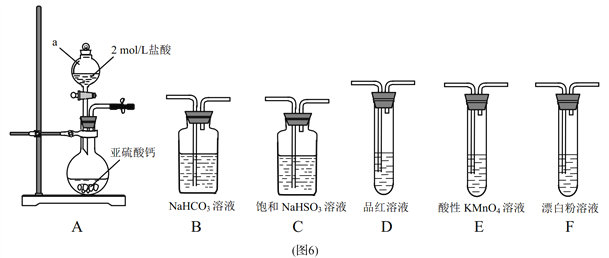
(1)装置 A 中仪器a的名称为 ____________。
(2)选用图6中的装置和药品探究亚硫酸与次氯酸的酸性强弱:
①甲同学认为按 A→C→F→尾气处理顺序连接装置可以证明亚硫酸和次氯酸的酸性强弱,乙同学认为该方案不合理,其理由是_________________________。
②丙同学设计的合理实验方案为:按照 A→C→____ →E→_____ →F→尾气处理(填字母)顺序连接装置。 E装置的作用是________,证明亚硫酸的酸性强于次氯酸的实验现象是_______ 。
(3)为了测定装置A残液中SO2的含量,量取10.00mL残液于圆底烧瓶中,加热使SO2全部蒸出,用20.00mL0.0500mol/L的酸性KMnO4溶液吸收。充分反应后,再用0.2 000mol/L的K I标准溶液滴定过量的 KMnO 4,消耗 KI溶液15.00mL。
已知:5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+
10I- +2MnO4-+16H+=2Mn 2+ +5I 2+8H2O
①残液中SO 2 的含量为_______ g·L-1。
②若滴定过程中不慎将 KI标准溶液滴出锥形瓶外少许,使测定结果______(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用无机矿物资源生产部分材料的流程示意图如下。下列说法正确的是( )

(注:铝土矿中含有A12O3、SiO2、Fe2O3)
A. 在铝土矿制备较高纯度A1的过程中只用到NaOH溶液、CO2气体、冰晶石
B. 石灰石、纯碱、石英、玻璃都属于盐,都能与盐酸反应
C. 在制粗硅时,氧化剂与还原剂的物质的量之比为1∶2
D. 黄铜矿(CuFeS2)与O2反应产生的Cu2S、SO2均是还原产物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com