
【题目】硫、碳、氮等是重要的非金属元素。请回答下列有关问题:
(1)H2S广泛存在于化石燃料中,因此H2S的吸收和利用是化石燃料化工中的一项重要任务。
①H2S可用NaClO溶液吸收,吸收后的溶液既能使AgNO3溶液生成白色沉淀,也能使Ba(NO3)2 溶液生成白色沉淀,则H2S用过量NaClO溶液吸收的离子方程式为_______________________。
②利用多硫化物(如Na2Sx)吸收H2S,其吸收原理可用以下四步反应表示:
ⅰ.H2S+OH-=HS-+H2O; ⅱ.2HS-![]() H2↑+S22-;
H2↑+S22-;
ⅲ.H2S+S22-=2HS-+S↓; ⅳ.HS-+H2O=H2S+OH-。
四步反应的总反应中的生成物是_______,在总反应中,多硫化物的作用是_____________。
(2)25℃时,H2CO3、NH3H2O在水中的电离平衡常数如下表:
弱电解质 | H2CO3 | NH3H2O |
电离常数 | Ka1=4.0×l0-7 Ka2=5.0×l0-11 | Kb=2.0×10-5 |
①判断0.1 molL-1的(NH4)2CO3溶液呈_______性(填“酸”“中”或“碱”),该溶液中c(CO32-)、c(HCO3-)、c(NH4+)的浓度由大到小的顺序为______________。
②0.50 mol L-1的Na2CO3溶液的pH=_______(忽略CO32-第二步水解和H2O的电离)。
③25℃时,Mg(OH)2的Ksp=2.0×10-11,要使0.002 molL-1的MgSO4溶液中生成Mg(OH)2沉淀,应调整溶液pH不低于________。
【答案】 6ClO-+H2S=4Cl-+SO42-+2HClO H2、S 催化剂和溶剂 碱 c(NH4+)>c(CO32-)>c(HCO3-) 12 10
【解析】本题考查化学工艺流程,(1)①反应后的溶液能使AgNO3溶液产生白色沉淀,说明含有Cl-,即ClO-→Cl-,也能使Ba(NO3)2溶液生成白色沉淀,说明有SO42-的生成,即H2S→SO42-,离子反应方程式为ClO-+H2S→Cl-+SO42-,根据化合价升降法进行配平,4ClO-+H2S→4Cl-+SO42-,反应前后所带电荷数守恒,因此反应后有4molH+,因为NaClO是过量,发生H+与ClO-反应生成HClO,即离子反应方程式为:6ClO-+H2S=4Cl-+SO42-+2HClO;②四个反应方程方式相加,得到H2S=H2+S,因此生成物是H2和S,多硫化物的作用是催化剂和溶剂;(2)根据水解平衡常数、电离平衡常数、水的离子积之间的关系, ![]() ,NH4+的水解常数为1×10-14/2.0×10-5=5×10-10,CO32-的水解常数为1×10-14/5×10-11=2×10-4,NH4+的水解程度小于CO32-的水解程度,溶液显碱性,离子浓度大小顺序是c(NH4+)>c(CO32-)>c(HCO3-);②CO32-的水解常数为1×10-14/5×10-11=2×10-4,Kh=
,NH4+的水解常数为1×10-14/2.0×10-5=5×10-10,CO32-的水解常数为1×10-14/5×10-11=2×10-4,NH4+的水解程度小于CO32-的水解程度,溶液显碱性,离子浓度大小顺序是c(NH4+)>c(CO32-)>c(HCO3-);②CO32-的水解常数为1×10-14/5×10-11=2×10-4,Kh=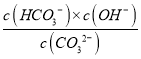 ,水解的程度微弱,c(CO32-)=0.5mol·L-1,CO32-+H2O
,水解的程度微弱,c(CO32-)=0.5mol·L-1,CO32-+H2O![]() HCO3-+OH-,c(HCO3-)=c(OH-),c(OH-)=
HCO3-+OH-,c(HCO3-)=c(OH-),c(OH-)= ![]() mol·L-1=1×10-2mol·L-1,即pH=12;③要使出现氢氧化镁沉淀,满足Ksp=c(Mg2+)×c2(OH-),c(OH-)=
mol·L-1=1×10-2mol·L-1,即pH=12;③要使出现氢氧化镁沉淀,满足Ksp=c(Mg2+)×c2(OH-),c(OH-)= 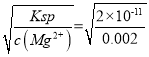 =10-4mol·L-1,即pH=10。
=10-4mol·L-1,即pH=10。


科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)是白色粉末,不溶于水、乙醇及稀硫酸,在空气中迅速被氧化成绿色,常用作有机合成工业中的催化剂。实验室拟以下列方法制取CuCl:在CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl。试回答以下问题:
(1)CuCl制备过程中需配制物质的量浓度为2.0 mol/L的CuSO4溶液。
①配制950 mL 2.0 mol/L的CuSO4溶液应称取胆矾的质量为____ ___g。
②某学生实际配制CuSO4溶液的浓度为1.8 mol/L,原因可能是__ ___。
A.托盘天平的砝码生锈 B.容量瓶中原来存有少量蒸馏水
C.溶解后的烧杯未经多次洗涤 D.胶头滴管加水定容时仰视刻度
(2)写出用上述方法制备CuCl的离子方程式_____ ____。
(3)在上述制取过程中,经过滤得到CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70℃干燥2小时,冷却,密封包装即得产品。其中“于70℃真空干燥”的目的是 ; _。(回答两点)
(4)据世界卫生组织统计,最常用的避孕环含金属铜,避孕过程中生成了CuCl。其原因是铜与人体分泌物中的盐酸以及子宫内的空气反应:Cu+HCl+O2=CuCl+HO2,HO2(超氧酸) 不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示正确的是____ __ ___。
A. 氧化产物是HO2
B. HO2在碱中能稳定存在
C. HO2的电离方程式是HO2![]() H+ + O2-
H+ + O2-
D. 1mol Cu 参加反应有2mol电子发生转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种黄绿色易溶于水的气体,常用作饮用水消毒。实验室通过如下过程制备二氧化氯。下列说法正确的是

A. 电解时发生反应的离子方程式为:NH4++3Cl-![]() 2H2↑+NCl3
2H2↑+NCl3
B. 溶液X中大量存在的阴离子有Cl-、OH-
C. 可用饱和食盐水除去ClO2中的NH3
D. 可用明矾除去饮用水中残留的NaClO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol金属Al全部转化为Al(OH)3,过程中共消耗HCl a mol、NaOH b mol,则a+b最小值为
A. 4 B. 6 C. 8 D. 16
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用密度为1.25g·mL-1,质量分数为36.5%的浓盐酸配制成240mL 0.1mol/L的稀盐酸,请回答:
(1)浓盐酸的物质的量浓度为________mol/L
(2)配制240mL 0.1mol/L的稀盐酸,应选择_________mL的容量瓶,量取浓盐酸的体积为________ml。
(3)完成本实验必需用到的仪器有:量筒、玻璃棒、烧杯、________、容量瓶等
(4)定容时,加水超过了刻度线,应怎样操作:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中错误的是
A. 蒸发时,当蒸发皿中出现较多固体即停止加热
B. 蒸馏时,温度计水银球应靠近蒸馏烧瓶的支管口处
C. 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D. 焰色反应时,用稀硫酸洗净铂丝,并在火焰上灼烧至无色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳家族的新成员C60,它具有空心的类似足球的结构,被称为足球烯,下列有关C60的说法正确的是( )
A.C60是一种新型的化合物
B.C60和石墨都是碳的同分异构体
C.C60中含有非极性键,是原子晶体
D.C60相对分子质量为720
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水MgBr2可用作催化剂。实验室采用镁屑与液溴为原料制备无水MgBr2,装置如下图所示(夹持仪器略去)。主要步骤如下:

步骤l:三颈瓶中装入10g镁屑和150mL无水乙醚,装置B中加入适量的液溴。
步骤2:缓慢通入干燥的氮气,直至溴完全导入三颈瓶中。
步骤3:反应完毕后恢复至室温,过滤,将滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品。
步骤4:常温下用苯溶解粗品,冷却至0℃,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至160℃分解得无水MgBr2产品。
已知:①Mg和Br2反应剧烈放热;MgBr2具有强吸水性。
②MgBr2+3C2H5OC2H5= MgBr2·3C2H5OC2H5
请回答:
(1)仪器A的名称是___________,它在实验中的作用是____________。
(2)步骡2中,可以将B装置中的溴完全导入三颈瓶中的原因是_______;该实验如果将所用液溴一次性全部加入三颈瓶中,其后果是_____________。
(3)步骡3中,第一次过滤得到的固体物质是______;根据步骤3、4,请总结出三乙醚合溴化镁所具有的物理性质:_________。
(4)请根据Mg的性质设计实验证明O2的氧化性比N2的强:________。
(5)将步骤得到的产品在干燥器中冷却到室温后,称量,其质量为61.4g。则该实验制取MgBr2的产率是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com