
| A. | 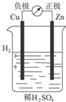 Cu-Zn原电池 | B. | 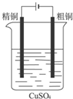 粗铜的精炼 | C. | 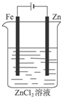 铁片镀锌 | D. | 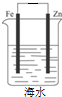 减缓铁腐蚀 |
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 原电池将化学能转变为电能 | |
| B. | 原电池将电能转变为化学能 | |
| C. | 中和反应放热说明中和反应前后能量不守恒 | |
| D. | 吸热反应中生成物的总能量低于反应物的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | c(HCOO-)<c(Na+) | B. | c(HCOO-)>c(Na+) | C. | c(OH-)>c(HCOO-) | D. | c(OH-)<c(HCOO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Ca2CO3+2HCl═CaCl2+H2O+CO2↑ | B. | 2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$ 2H2O+O2↑ | ||
| C. | Cu+4HNO3(稀)═Cu(NO3)2+2NO↑+2H2O | D. | NaCl+AgNO3═AgCl↓+NaNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 分子式是C20H12O4 | B. | 能与NaOH稀溶液反应,溶液显红色 | ||
| C. | 能与溴水反应,溶液显红色 | D. | 与羧酸发生酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当pH=7时,若V1=V2,则一定是c2>c1 | |
| B. | 在任何情况下都满足c(Na+)+c(H+)=c(CH3COO-)+c(OH-) | |
| C. | 若pH>7,则一定是c1V1>c2V2 | |
| D. | 若V1=V2,c1=c2,则c(CH3COO-)+c(CH3COOH)=c(Na+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com