
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③② | C. | ③① | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②⑤⑥ | C. | ③⑤⑥⑦ | D. | ①③④⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150mL 1 mol/L氯化钠溶液 | B. | 75mL 2 mol/L氯化镁溶液 | ||
| C. | 50mL 3 mol/L氯化钾溶液 | D. | 50mL 1 mol/L氯化铁溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①中水的电离程度最小,③中水的电离程度最大 | |
| B. | 等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:④最大 | |
| C. | 将四份溶液稀释相同倍数后,溶液的pH:③>④,②>① | |
| D. | 将②、③混合,若pH=7,则消耗溶液的体积:②<③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜片加入FeCl3溶液中:Cu+2Fe3+═2Fe2++Cu2+ | |
| B. | 盐酸中加入Ca CO3:CO32-+2H+═H2O+CO2↑ | |
| C. | Na2O2与H2O反应:Na2O2+H2O═2Na++2OH-+O2↑ | |
| D. | 向Fe(OH)2中加入足量稀硝酸:Fe(OH)2+2H+═Fe2++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 时间t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.2 | 0.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
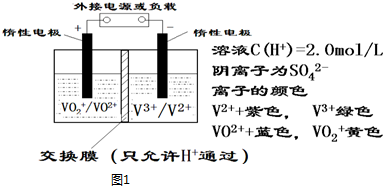
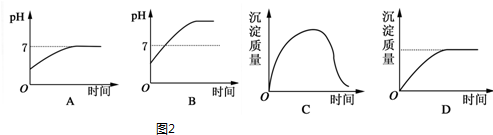
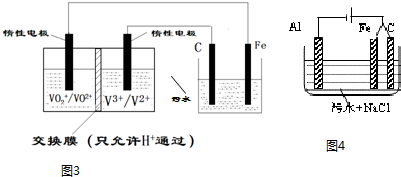
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com