
将CO2通入NaOH溶液中,所得产物随通入的CO2的物质的量的不同而不同。完成下列填空。
(1)250 mL 1 mol/L的NaOH溶液,最多可吸收CO2 L(标准状况下)。
(2)向250 mL 2 mol/L的NaOH溶液中通入一定量CO2,溶液增重4.4 g,将所得溶液蒸干,计算所得固体中各成分的物质的量。
向未知浓度、体积为V L的 NaOH溶液中缓缓通入一定体积(标准状况下)的CO2,充分反应后,在减压低温的条件下蒸发溶液,得到白色固体。
(3)若反应中CO2和NaOH均无剩余,反应后向溶液中加入过量的澄清石灰水生成m1 g 白色沉淀。
①根据以上数据,用代数式表示CO2的体积V(CO2)= 。
②根据以上数据,推理计算出NaOH溶液的浓度范围。
(4)写出确定NaOH浓度的实验步骤,并用代数式表示NaOH溶液的浓度。(设计实验方案时,只能用题中提供的CO2和NaOH溶液,不得使用其它化学试剂。)
实验步骤: 。c(NaOH)= 。
(1)5.6 L (1分)
(2)Na2CO3 0.1 mol ; NaOH 0.3 mol(4分)
(3)①V(CO2)=0.224m1 L 2分) ② ≤ c(NaOH) ≤
≤ c(NaOH) ≤  (每种情况各1分,共3分)
(每种情况各1分,共3分)
(4)取V L NaOH溶液,称量,缓缓向其中通入CO2直至恒重,称量。测得其增重为m3 g。(2分)
c(NaOH)=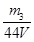 mol/L(2分)
mol/L(2分)
或者:取V L NaOH溶液,缓缓向其中通入过量的CO2,充分反应后减压低温蒸发溶液,得固体NaHCO3,称其质量为m3 g。(2分)
c(NaOH)=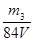 mol/L(2分) (其它合理答案也给分)
mol/L(2分) (其它合理答案也给分)
解析试题分析:(1)250 mL 1 mol/L的NaOH溶液中氢氧化钠的物质的量为0.25mol,则根据方程式NaOH+CO2=NaHCO3可知,最多可吸收CO2的物质的量为0.25mol,在标准状况下的体积为0.25mol×22.4L/mol=5.6L。
(2)向250 mL 2 mol/L的NaOH溶液中通入一定量CO2,溶液增重4.4 g,这说明参加反应的CO2的质量是4.4g,物质的量为0.1mol。氢氧化钠的物质的量为0.5mol,因此根据反应式2NaOH+CO2=Na2CO3+H2O可知氢氧化钠是过量的,所以所得固体为氢氧化钠和碳酸钠的混合物,其中碳酸钠0.1mol,氢氧化钠是0.5mol-0.1mol×2=0.3mol。
(3)①生成物不论是碳酸钠还是碳酸氢钠均能与氢氧化钙反应生成碳酸钙白色沉淀,则根据碳元素守恒可知CO2的物质的量是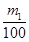 mol,在标准状况下的体积为
mol,在标准状况下的体积为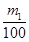 mol×22.4L/mol=0.224m1 L。
mol×22.4L/mol=0.224m1 L。
②如果生成物只有NaHCO3时,则根据原子守恒可知c(NaOH)=  ;当生成物只有Na2CO3时,同样依据原子守恒可知c(NaOH)=
;当生成物只有Na2CO3时,同样依据原子守恒可知c(NaOH)=  ;当生成物是Na2CO3和NaHCO3时,消耗NaOH在上述两者之间。所以:
;当生成物是Na2CO3和NaHCO3时,消耗NaOH在上述两者之间。所以: ≤ c(NaOH) ≤
≤ c(NaOH) ≤  。
。
(4)要测定氢氧化钠溶液的浓度,则可以将其转化为碳酸氢钠,然后通过称量其质量得出氢氧化钠的质量,进而得出其浓度,或者计算参加反应的二氧化碳质量,进而得出氢氧化钠的物质的量,所以正确的实验步骤可以为:取V L NaOH溶液,称量,缓缓向其中通入CO2直至恒重,称量。测得其增重为m3 g。由于增加的质量即为参加反应的CO2质量,所以根据原子守恒可知碳酸氢钠的物质的量为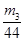 ,则氢氧化钠的物质的量也是
,则氢氧化钠的物质的量也是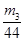 ,所以其浓度为
,所以其浓度为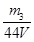 。或者取V L NaOH溶液,缓缓向其中通入过量的CO2,充分反应后减压低温蒸发溶液,得固体NaHCO3,称其质量为m3 g。则碳酸氢钠的物质的量为
。或者取V L NaOH溶液,缓缓向其中通入过量的CO2,充分反应后减压低温蒸发溶液,得固体NaHCO3,称其质量为m3 g。则碳酸氢钠的物质的量为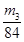 ,则根据原子守恒可知氢氧化钠的物质的量也是
,则根据原子守恒可知氢氧化钠的物质的量也是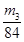 ,所以其浓度为
,所以其浓度为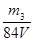 。
。
考点:考查氢氧化钠与二氧化碳反应的有关判断与计算


科目:高中化学 来源: 题型:单选题
将0.8g NaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1 mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是 
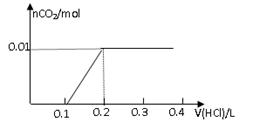
A B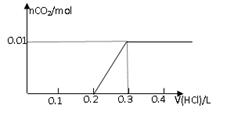

C D
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分)某同学按下列步骤配制500 mL 0.2 mol·L-1 KCl溶液,请回答有关问题。
| 实验步骤 | 有关问题 |
| ①计算所需KCl的质量 | 需要KCl的质量为________g(保留小数点后一位) |
| ②称量KCl固体 | 称量需要用到的主要仪器是________________ |
| ③将KCl加入100 mL烧杯中,并加入适量水 | 为了加快溶解速率,可以采取哪些措施? ________________ |
| ④将烧杯中溶液转移至500 mL容量瓶中 | 为了防止溶液溅出,应采取什么措施? __________________ |
| ⑤向容量瓶中加蒸馏水至刻度线 | 在进行此操作时当加水至离刻度线1 cm~2 cm处应如何操作?____________________ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(5分)
(1)在下列变化中:①碘的升华 ②烧碱熔化 ③MgCl2溶于水 ④HCl溶于水,
未发生化学键破坏的是 ,仅发生离子键破坏的是 。(填写序号)
(2)下列五种物质中①Ne ②Na2O③NH3④KOH,只存在共价键
的是 ,既存在共价键又存在离子键的是 。(填写序号)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某氮肥NH4HCO3中混有少量(NH4)2CO3,现采用下列方案测定该氮肥中(NH4)2CO3的质量分数:称取5.7 g样品与2.0 mol·L-1 NaOH溶液混合,完全溶解后,低温加热使其充分反应(该温度下铵盐不分解),并使生成的氨气全部被硫酸吸收,测得氨气的质量与所用NaOH溶液体积的关系如图所示。请回答下列问题: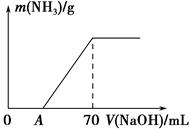
(1)A点前样品与NaOH反应的离子方程式为 。
(2)为使生成的氨气被硫酸吸收时不发生倒吸,可以选用下列装置中的 (填字母序号)。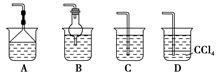
(3)样品中(NH4)2CO3的质量分数是 %(保留一位小数)。
(4)当V(NaOH)=50 mL时,生成NH3的质量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物FeClx的化学式,可用离子交换和滴定的方法。实验中称取0.54 g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40 mol·L-1的盐酸滴定,滴至终点时消耗盐酸25.0 mL。计算该样品中氯的物质的量,并求出FeClx中x值:
__________________________________________________(列出计算过程);
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe)∶n(Cl)=1∶2.1,则该样品中FeCl3的物质的量分数为________。在实验室中,FeCl2可用铁粉和________反应制备,FeCl3可用铁粉和________反应制备;
(3)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为_________________;
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为____________________。与MnO2Zn电池类似,K2FeO4Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为_____________________,该电池总反应的离于方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
实验室配制480 mL 0.600 mol·L-1的NaCl溶液,有如下操作步骤:
①把称量好的NaCl晶体放入小烧杯中,加适量蒸馏水溶解
②把①所得溶液小心转入容量瓶中
③继续向容量瓶中加蒸馏水至液面距刻度线1 cm~2 cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面与刻度线相切
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀
⑤将容量瓶瓶塞塞紧,充分摇匀
请填写下列空白:
(1)操作步骤的正确顺序为(填序号) 。
(2)实验室有如下规格的容量瓶:①100 mL,②250 mL,③500 mL,④1000 mL,本实验选用(填序号) 。
(3)本实验用到的基本实验仪器除容量瓶、玻璃棒外,还有 。
(4)需要使用玻璃棒的操作有 (填步骤序号),其作用为 。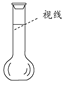
(5)误差分析:(填“偏高”“偏低”或“无影响”)
①称量NaCl时,物码倒置(1 g以下用游码) 。
②某同学观察液面的情况如右图所示,对所配溶液浓度将有何影响 。
③没有进行操作步骤④ 。
④加蒸馏水时不慎超过了刻度线,立即用胶头滴管将多余的水吸出 。
⑤容量瓶中原来有少量水 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
将24.4 gNaOH固体溶于水配成100 mL溶液,其密度为1.219 g/mL。
(1)该溶液中NaOH的物质的量浓度为 。
(2)该溶液中NaOH的质量分数为 。
(3)从该溶液中取出10 mL,其中NaOH的物质的量浓度为 ,NaOH的质量分数为 ,溶液的密度为 ,含NaOH的质量为 ,含NaOH的物质的量为 。
(4)将取出的10 mL溶液加水稀释到100 mL,稀释后溶液中NaOH的物质的量浓度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下图是200 mg MnC2O4·2H2O晶体放在坩埚里加热分解时,所得固体产物的质量(m)随温度(T)变化的曲线(已知草酸锰不稳定,但其中锰元素的化合价在300 ℃以下不变)。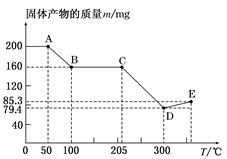
试回答下列问题:
(1)写出B点固体产物的化学式:_________________________________________。
(2)从B点到C点过程中固体物质质量不变的原因是_____________________________________________________。
(3)通过计算确定D点产物的相对分子质量,并推断其合理的化学式:____________
(4)从D点到E点过程中固体物质质量增加的原因是___________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com