
【题目】已知电解质溶液电导率越大导电能力越强。常温下用![]() 溶液分别滴定
溶液分别滴定![]() 浓度均为
浓度均为![]() 的盐酸和醋酸溶液,测得滴定过程中溶液的电导率如图所示。下列说法错误的是( )。
的盐酸和醋酸溶液,测得滴定过程中溶液的电导率如图所示。下列说法错误的是( )。
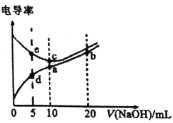
A.c点的混合液pH=7
B.e、d两点溶液混合后的溶液中:![]()
C.b点溶液中:![]()
D.a、b、c三点溶液中水的电离程度:![]()
【答案】D
【解析】
A.根据盐酸为强电解质溶液,醋酸为弱电解质溶液。因为电解质溶液电导率越大导电能力越强可知,c点为用![]() 滴定
滴定![]() 浓度为
浓度为![]() 的盐酸溶液,此时消耗
的盐酸溶液,此时消耗![]() 溶液为
溶液为![]() ,由HCl+NaOH=NaCl+H2O可知n(NaOH)=n(HCl),所以混合液pH=7,故A正确;
,由HCl+NaOH=NaCl+H2O可知n(NaOH)=n(HCl),所以混合液pH=7,故A正确;
B. 根据盐酸为强电解质溶液,醋酸为弱电解质溶液,分析可知d点所在的曲线代表滴定CH3COOH溶液的曲线,e点在的曲线代表滴定HCl溶液的曲线,分别加入5mL![]() 溶液后,两者混合后溶液为NaCl和CH3COOH,且n(NaCl)=n(CH3COOH),所以
溶液后,两者混合后溶液为NaCl和CH3COOH,且n(NaCl)=n(CH3COOH),所以![]() ,故B正确;
,故B正确;
C.b点表示等浓度的氢氧化钠与醋酸钠的混和液,根据电荷守恒c(Na+)+ c(H+)= c(OH-)+C(CH3COO-);根据物料守恒c(Na+)= 2C(CH3COO-)+ 2C(CH3COOH),所以C(OH-)=C(H+)+c(CH3COO-)+ 2C(CH3COOH),故 C正确;
D.a点表示醋酸钠溶液,c点表示氯化钠溶液,b点表示氢氧化钠与醋酸钠的混合液,b点水电离受到氢氧化钠的抑制,a点水电离受到醋酸钠的促进,c点氯化钠对水电离无影响,所以a、b、c三点溶液中水的电离程度: a>c>b , 故D错误;
故答案为D。


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】有氯化钠和碘化钠的混合物共26.7 g,溶于水,通入足量氯气后,蒸干、灼烧,固体质量变为 17.55 g。
(1)原混合物中碘化钠的质量是________。
(2)原混合物中氯化钠的质量分数是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应①2BrO3-+Cl2=Br2+2ClO3-;②5Cl2+I2+6H2O=2HIO3+10HCl;③ClO3-+5Cl-+6H+=3Cl2+3H2O。下列物质氧化能力强弱顺序正确的是
A.![]() B.
B.![]()
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为V L的恒容密闭容器中盛有一定量H2,通入Br2(g)发生反应H2(g)+Br2(g)![]() 2HBr(g);ΔH<0。当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示。下列说法正确的是
2HBr(g);ΔH<0。当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示。下列说法正确的是
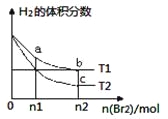
A. 若b、c点的平衡常数分别为K1、K2,则K1>K2
B. a、b两点的反应速率:b>a
C. 为了提高Br2(g)的转化率,可采取增加Br2(g)通入量的方法
D. 若平衡后保持温度不变,压缩容器体积平衡一定不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,反应H2(g)+CO2(g)![]() H2O(g)+CO(g)的平衡常数K=
H2O(g)+CO(g)的平衡常数K=![]() 。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示:
。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示:
甲 | 乙 | 丙 | |
c(H2)/(mol·L-1) | 0.010 | 0.020 | 0.020 |
c(CO2)/(mol·L-1) | 0.010 | 0.010 | 0.020 |
下列判断不正确的是( )
A. 反应开始时,丙容器中化学反应速率最大,甲容器中化学反应速率最小
B. 平衡时,乙容器中CO2的转化率大于60%
C. 平衡时,甲容器中和丙容器中H2的转化率均是60%
D. 平衡时,丙容器中c(CO2)是甲容器中的2倍,是 0.012 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮、硫及其化合物对生产、生活有重要的意义。
(1)以![]() 与
与![]() 为原料可合成尿素。已知:
为原料可合成尿素。已知:
①![]()
![]()
②![]()
![]()
③![]()
![]()
写出NH3和CO2合成尿素和液态水的热化学方程式________。
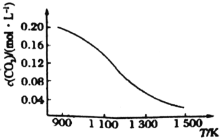
(2)高温下,CO2与足量的碳在密闭容器中实现反应:![]() 。向容积为1L的恒容容器中加入0.2molCO2,在不同温度下达到平衡时CO2的物质的量浓度随温度的变化如图所示。则该反应为________(填“放热”或“吸热”)反应;某温度下若向该平衡体系中再通入0.2molCO2,达到新平衡后,体系中CO的百分含量________(填“变大”、“变小”或“不变”)。
。向容积为1L的恒容容器中加入0.2molCO2,在不同温度下达到平衡时CO2的物质的量浓度随温度的变化如图所示。则该反应为________(填“放热”或“吸热”)反应;某温度下若向该平衡体系中再通入0.2molCO2,达到新平衡后,体系中CO的百分含量________(填“变大”、“变小”或“不变”)。
(3)一定量的![]() 与足量的碳在体积可变的恒压密闭容器中反应:
与足量的碳在体积可变的恒压密闭容器中反应:![]() ,平衡时体系中气体体积分数与温度的关系如图所示:
,平衡时体系中气体体积分数与温度的关系如图所示:
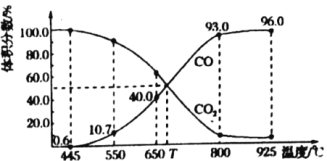
①650℃时,反应达平衡后![]() 的转化率为________。
的转化率为________。
②![]() ℃时,平衡常数
℃时,平衡常数![]() ________
________![]() (用平衡分压代替平衡浓度计算,分压
(用平衡分压代替平衡浓度计算,分压![]() 总压
总压![]() 体积分数)。
体积分数)。
(4)![]() 与
与![]() 能发生反应:
能发生反应:![]()
![]() 在固定体积的密闭容器中,使用某种催化剂,改变原料气配比进行多次实验(各次实验的温度可能相同,也可能不同),测定
在固定体积的密闭容器中,使用某种催化剂,改变原料气配比进行多次实验(各次实验的温度可能相同,也可能不同),测定![]() 的平衡转化率。部分实验结果如图所示:
的平衡转化率。部分实验结果如图所示:
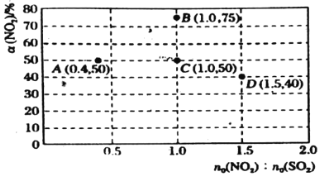
①当容器内________(填标号)不再随时间的变化而改变时,反应达到平衡状态。
A.气体的压强 B.气体的平均摩尔质量 C.气体的密度 D.![]() 的体积分数
的体积分数
②如果要将图中C点的平衡状态改变为B点的平衡状态,应采取的措施是________。
③若A点对应实验中,![]() 的起始浓度为
的起始浓度为![]() ,经过
,经过![]() 达到平衡状态,该时段化学反应速率
达到平衡状态,该时段化学反应速率![]() ________
________![]() 。
。
④图中C、D两点对应的温度分别为![]() ℃和
℃和![]() ℃,通过计算判断
℃,通过计算判断![]() ________
________![]() (填“
(填“![]() ”、“
”、“![]() ”或“
”或“![]() ”)。
”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米氧化锌是一种多功能性的新型无机材料,在橡胶、玻璃、涂料等各个领域广泛的应用。工业由粗氧化锌(含少量FeO、CuO 等杂质) 制备活性氧化锌的工业流程如下:
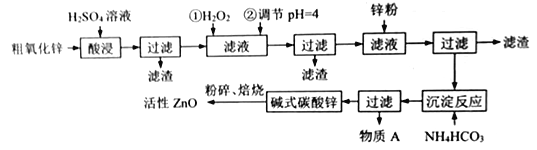
已知:Fe3+、Fe2+、Cu2+完全沉淀的pH分别是:3.2,8.1,6.7
(1)“酸浸”时用的硫酸溶液的密度为1.4g/mL,质量分数为70%,则该硫酸的物质的量浓度为____。
(2)焙烧前粉碎的目的是____________________________________________。
(3)滤液中加锌粉的目的是_____________________________________。
(4)物质A的主要成分_______________(填化学式),检验A中阳离子的方法是_______________。
(5)滤液中加H2O2发生反应的离子方程式__________________________。
(6)6.82g碱式碳酸锌[aZn(OH)2·bZnCO3·cH2O]恰好溶解在40mL3mol/LHCl中,同时产生448mLCO2(标准状况下),试推算碱式碳酸锌的化学式为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对反应A+B=AB来说,常温下按以下情况进行反应:
①20 mL溶液中含A、B各0.01 mol
②50 mL溶液中含A、B各0.05 mol
③0.1 mol·L-1的A、B溶液各10 mL
④0.5 mol·L-1的A、B溶液各50 mL
四者反应速率的大小关系是
A.②>①>④>③B.④>③>②>①
C.①>②>④>③D.①>②>③>④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某密闭容器中加入HBr,在一定条件下发生反应∶2HBr(g)![]() Br2(g)+H2(g), c(HBr)随反应时间的变化如曲线①所示,分别改变一个条件,得到曲线②、③,下列说法正确的是( )
Br2(g)+H2(g), c(HBr)随反应时间的变化如曲线①所示,分别改变一个条件,得到曲线②、③,下列说法正确的是( )
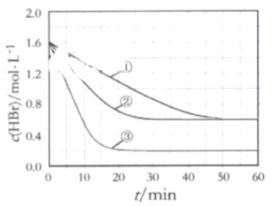
A.该反应正反应为放热反应
B.曲线①,0~ 50 min用H2表示的平均反应速率为0.02 mol﹒L-1﹒min-1
C.曲线②,可能使用了催化剂或增大了压强
D.曲线③达到平衡时,往容器中加入浓度均为0.2 mol﹒L-1的三种物质,平衡将向正反应方向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com