
| A、若V1≥V2,c1=c2,则混合液的pH>7 |
| B、若混合溶液的pH=7,则c1V1<c2V2 |
| C、若c1=c2,混合液中c(NH4+)═c(Cl-),则V1>V2 |
| D、若混合溶液的pH>7,则混合液中c(NH4+)>c(OH-)>c(Cl-)>c(H+) |


科目:高中化学 来源: 题型:
 氧化还原反应在生产、生活中具有广泛的用途.
氧化还原反应在生产、生活中具有广泛的用途.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、-OH与OH-组成元素相同,含有的质子数也相同 |
B、NH4Cl的电子式为: |
C、丙烷分子的比例模型示意图: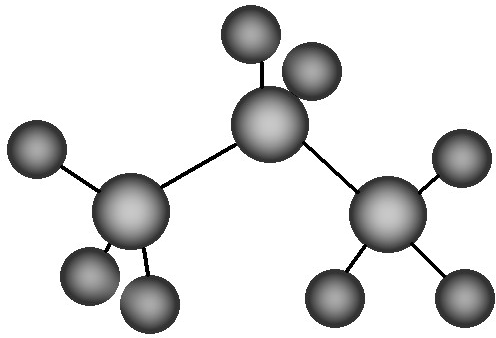 |
D、CO2分子的比例模型示意图: |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ksp越小,则该物质在水中的溶解度肯定越小 |
| B、Ksp小的物质不可能转化为Ksp大的物质 |
| C、Ksp的大小只取决于物质属性,而与温度等其它因素无关 |
| D、易溶于水的物质也可能存在沉淀溶解平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①>②>④>③ |
| B、②>③>④>① |
| C、①>②>③>④ |
| D、③>②>④>① |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同周期元素的离子中W离子半径最小 |
| B、元素X能与元素Y形成共价化合物X2Y2 |
| C、工业上用二氧化锰和浓盐酸制取Q的单质 |
| D、元素Z、W、R的最高价氧化物对应的水化物之间均能反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2CO3溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| B、相同条件下,pH=5的 ①NH4Cl溶液、②CH3COOH溶液、③稀盐酸溶液中由水电离出的c(H+):①>②>③ |
| C、NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-)+c(CO32-) |
| D、0.1mol?L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 依据叙述,写出下列反应的热化学方程式.
依据叙述,写出下列反应的热化学方程式.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com