
| A. | 该电池的工作环境应在高温条件下 | |
| B. | 正极反应:O2+2H2O+4e-═4OH- | |
| C. | 电池工作时葡萄糖在负极上失去电子发生还原反应 | |
| D. | 电池工作时H+由负极移向正极,电解质溶液的pH增大 |
分析 A.该电池是燃料原电池,反应条件温和;
B.在正极上发生得电子的还原反应;
C.葡萄糖在负极上失去电子被氧化,发生氧化反应;
D.原电池中阳离子移向正极,根据电池反应判断酸碱性的变化.
解答 解:A.该电池是燃料原电池,电池中没有发生燃烧反应,反应条件温和,所以不是高温条件,故A错误;
B.在电池正极上发生得电子的还原反应,即O2+4H++4e-═2H2O,故B错误;
C.葡萄糖在负极上失去电子被氧化,发生氧化反应,故C错误;
D.电池工作时H+由负极移向正极,已知C6H12O6(葡萄糖)+6O2$\frac{\underline{\;\;\;\;\;\;\;酸\;\;\;\;\;\;\;}}{酸性介质}$6CO2+6H2O产生水将溶液稀释,电解液的pH变大,故D正确;
故选:D.
点评 本题考查化学电源新型电池,明确原电池原理解答本题的关键,题目难度中等,侧重于考查学生的分析能力和对基础知识的应用能力.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:解答题
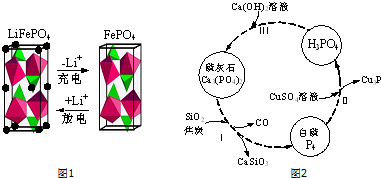
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
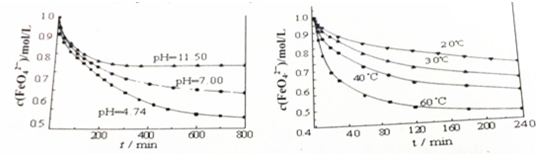
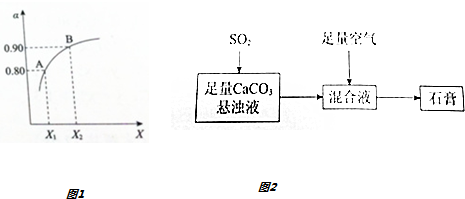
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 1 | 操作 | 现象 | 结 论 |
| A | 向白色AgCl悬浊液中滴加0.1mol/LKI溶液 | 试管中白色沉淀转化为黄色沉淀. | Ksp(AgCl)>Ksp(AgI) |
| B | 向装有Fe(NO3)2溶液的试管中加入几滴稀H2SO4 | 溶液颜色基本不变 | Fe(NO3)2与H2SO4不反应 |
| C | 向Na2SiO3溶液中滴加盐酸 | 溶液变浑浊 | 非金属性:Cl>Si |
| D | SO2通入足量的稀Fe(NO3)3溶液 | 溶液由棕黄色变为浅绿色,后立即又变成棕黄色 | 氧化性:HNO3>H2SO4>Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏实验开始时应先加热后通冷凝水 | |
| B. | 不能用湿润的pH试纸测定溶液的pH,否则必然会使实验结果产生误差 | |
| C. | 提取海带中碘元素时,为保证I-完全氧化为I2,加入的氧化剂(H2O2或新制氯水)应过量 | |
| D. | 在中和热测定实验中,为准确测得反应前后的温差,应将已分别测得温度的氢氧化钠溶液与盐酸在量热剂中快速混合,并不断轻轻搅拌,测量混合液的最高温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18 g H2O中含有的质子数为10NA | |
| B. | 12 g C60中含有的碳原子数为60NA | |
| C. | 46 g NO2和N2O4混合气体中含有原子总数为3NA | |
| D. | 1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 | B. | 5 | C. | 6 | D. | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烃的相对分子量均为奇数 | |
| B. | 硝基化合物的相对分子量均是偶数 | |
| C. | 烃及烃的含氧衍生物的相对分子量均为偶数 | |
| D. | 酚、醛、氨基酸、酯的相对分子量均为奇数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com