
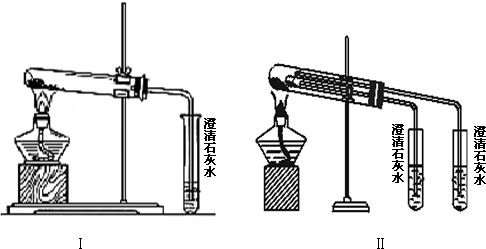
分析 (1)根据两个实验的区别分析,Ⅱ可以做对比实验;
(2)不直接加热碳酸氢钠就能分解更说明碳酸氢钠不稳定;
(3)碳酸氢钠加热分解生成碳酸钠、二氧化碳气体和水,书写化学方程式,根据差量进行计算,由此分析解答;
(4)根据反应方程式判断溶液中的溶质;碳酸根离子能和钙离子反应生成碳酸钙白色沉淀,向上层清液中加入氯化钙溶液,若产生白色沉淀,就证明有碳酸根离子.
解答 解:(1)实验Ⅰ与实验Ⅱ相比,实验Ⅱ可以做到一套装置同时进行两个对比实验,而实验I不能,故选D,
故答案为:D;
(2)碳酸钠直接加热,碳酸氢钠不直接加热,不直接加热的碳酸氢钠能分解而直接加热的碳酸钠不分解更能说明碳酸氢钠不稳定,
故答案为:NaHCO3;
(3)碳酸氢钠加热发生的反应方程式为:2NaHO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,
根据差量法:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O△m
106 62
m(Na2CO3) (m1-m2)g
碳酸钠的质量为:m(Na2CO3)=$\frac{106({m}_{1}-{m}_{2})}{62}$g=$\frac{53}{31}({m}_{1}-{m}_{2})$,
故答案为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑; $\frac{53}{31}({m}_{1}-{m}_{2})$;
(4)碳酸氢钠与氢氧化钙的物质的量之比为2:1时,反应方程式为2NaHCO3+Ca(OH)2=CaCO3↓+Na2CO3+2H2O,根据方程式知该溶液是碳酸钠溶液;该溶液中含有碳酸根离子,碳酸根离子能和钙离子生成白色沉淀,所以检验方法是:取上层清液于洁净的试管中加入适量CaCl2溶液,振荡,若有白色沉淀生成,则证明溶液中含有CO32-,
故答案为:取上层清液少许于洁净试管中,加入适量CaCl2溶液,若有白色沉淀生成,证明有CO32-.
点评 本题考查了NaHCO3性质实验方案的设计,题目难度中等,正确理解题干信息为解答关键,注意差量法的应用.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)已知:3H2(g)+3CO(g)═CH3OCH3(g)+CO2(g),△H=-247kJ/mol.一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是AE.
(1)已知:3H2(g)+3CO(g)═CH3OCH3(g)+CO2(g),△H=-247kJ/mol.一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是AE.| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.01 | 0.2 | 0.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某物质焰色反应呈黄色,结论:该物质一定是钠盐 | |
| B. | 某溶液中滴加KSCN溶液,溶液不变红,再滴加氯水,变红,结论:原溶液一定有Fe2+ | |
| C. | 无色溶液中加入BaCl2溶液,有白色沉淀产生,再加稀硝酸,沉淀不消失,结论:原溶液一定含有SO42- | |
| D. | 无色溶液中加入稀盐酸,产生无色无味气体,该气体能使澄清石灰水变浑浊,结论:原溶液一定含有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡时SO2的转化率:A>B | |
| B. | 可逆反应从开始到平衡放出的热量:A<B | |
| C. | 平衡时混合气体的总物质的量:A<B | |
| D. | 平衡时的化学反应速率:A>B |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时颜色的变化.实验时必须使用铁屑和6mol/L的硫酸,其他试剂任选.填写下列空白.
如图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时颜色的变化.实验时必须使用铁屑和6mol/L的硫酸,其他试剂任选.填写下列空白.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 | |
| 密度/g•cm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
| 沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  系统命名:2-乙基丙烷 系统命名:2-乙基丙烷 | |
| B. | 由分子式为C2H6O组成的物质一定是纯净物 | |
| C. | 正丁烷和异丁烷互为同系物 | |
| D. | 互为同系物的物质,在组成和结构上相似,所以化学性质也相似 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com