
| A. | K Na Li | B. | Al Mg Na | C. | N O C | D. | Cl S P |
分析 同一主族元素的第一电离能随着原子序数的增大而减小,原子半径依次增大,同一周期元素的第一电离能随着原子序数的增大而增大,原子半径依次减小,注意同一周期的第ⅡA元素的第一电离能大于第ⅢA族的,第ⅤA族的大于第ⅥA族的.同一周期中稀有气体的第一电离能最大,据此分析.
解答 解:A. K Na Li 处于同主族,原子半径依次减小,同主族自上而下电离能降低,故K、Na、Li的元素第一电离能逐渐升高,故A正确;
B.Na、Mg、Al属于同一周期元素且原子序数依次增大,原子半径依次减小,同一周期元素的第一电离能随着原子序数的增大而增大,但第ⅡA元素的第一电离能大于第ⅢA族的,所以第一电离能依次Mg>Al>Na,故B错误;
C.C、N、O属于同一周期元素且原子序数依次增大,原子半径依次减小,同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素的第一电离能大于相邻元素,故第一电离能顺序为:N>O>C,故C错误;
D.Cl、S、P同周期,原子序数依次减小,同周期自左而右原子半径减小,故Cl、S、P原子半径依次增大,同周期自左而右元素的第一电离能呈增大趋势,但P最外层3p能级容纳3的电子,为半满稳定状态,能量较低,第一电离能也高于同周期相邻元素,故第一电离能P>Cl>S,故D错误;
故选A.
点评 本题考查了第一电离能大小的判断,题目难度不大,根据元素周期律来分析解答即可,注意同一周期的第ⅡA元素的第一电离能大于第ⅢA族的,第ⅤA族的大于第ⅥA族的.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>Y | B. | 最高价含氧酸酸性:W>R | ||
| C. | 气态氢化物稳定性:Y>R | D. | 简单离子半径:Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
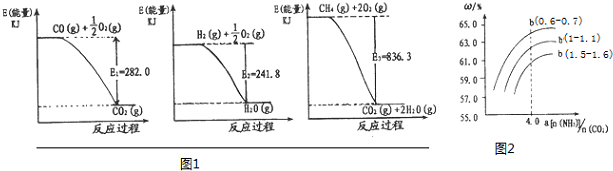
| 时间/S | 0 | 20 | 40 | 60 | 80 |
| N(NO2)/mol | 0.4 | n1 | 0.26 | n3 | n4 |
| N(N2O4)/mol | 0 | 0.05 | n2 | 0.08 | 0.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=1.8 mol•L-1•s-1 | B. | v(B)=0.3 mol•L-1•s-1 | ||
| C. | v(C)=0.6 mol•L-1•s-1 | D. | v(D)=1.6 mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na与水反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | FeCl3溶液腐蚀铜印刷电路板:Fe3++Cu═Fe2++Cu2+ | |
| C. | 明矾溶液中加入过量NaOH溶液:Al3++4OH-═AlO2-+2H2O | |
| D. | 盛放NaOH溶液的试剂瓶不能使用玻璃塞:SiO2+2OH-═SiO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 水合铜离子的模型如图1所示,1个水合铜离子中有4个配位键 | |
| B. | CaF2晶体的晶胞如图2所示,每个CaF2晶胞平均占有4个Ca2+,4个F- | |
| C. | H原子的电子云图如图3所示,H原子核外大多数电子在原子核附近运动 | |
| D. | 原子堆积模型如图4,可表示Mg原子的堆积方式 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com