


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
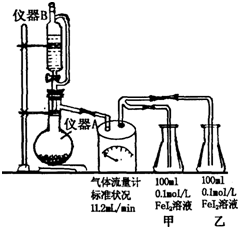 某研究性学习小组为探究Cl2的氧化性和I-的还原性强于Fe2+,设计了如图装置制取Cl2,并进行实验探究.回答下列问题:
某研究性学习小组为探究Cl2的氧化性和I-的还原性强于Fe2+,设计了如图装置制取Cl2,并进行实验探究.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
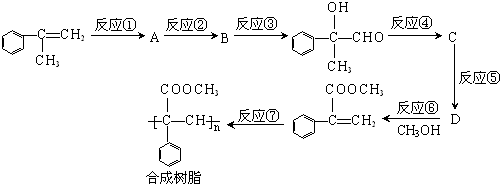
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
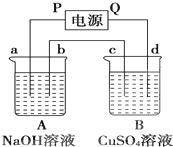 按如图装置实验,A、B两烧杯分别盛放200g10% NaOH溶液和足量CuSO4溶液.通电一段时间后,c极上有Cu析出.又测得烧杯A溶液的质量减少4.5g,电极均为石墨电极,试回答:
按如图装置实验,A、B两烧杯分别盛放200g10% NaOH溶液和足量CuSO4溶液.通电一段时间后,c极上有Cu析出.又测得烧杯A溶液的质量减少4.5g,电极均为石墨电极,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
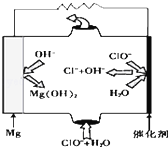 完成下列热化学方程式(化学方程式、电极反应式、表达式等)的书写:
完成下列热化学方程式(化学方程式、电极反应式、表达式等)的书写:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com