
分析 (1)根据盖斯定律,反应热只与始态与终态有关,与途径无关,始态相同、终态相同反应热相同;
(2)根据盖斯定律,利用途径Ⅱ构造途径Ⅰ,进行计算;
(3)根据碳完全燃烧放出的热量大于不完全燃烧放出的热量;
(4)根据书写热化学方程式的方法来分析;
(5)固体煤经处理变为气体燃料后,根据气体燃料具有的优点分析.
解答 解:(1)根据盖斯定律,反应热只与始态与终态有关,与途径无关,途径Ⅰ与途径Ⅱ的始态相同、终态相同反应热相等,
故答案为:等于;
(2)C(s)+H2O(g)═CO(g)+H2(g);△H2>0 ②
2CO(g)+O2(g)═2CO2(g);△H3<0③
2H2(g)+O2(g)═2H2O(g);△H4<0 ④
根据盖斯定律,②+③×$\frac{1}{2}$+④×$\frac{1}{2}$得C(s)+O2(g)═CO2(g),故△H1=△H2+$\frac{1}{2}$(△H3+△H4)
故答案为:△H1=△H2+$\frac{1}{2}$(△H3+△H4);
(3)因为碳完全燃烧放出的热量大于不完全燃烧放出的热量,所以△H1<△H,故答案为:<;
(4)12g 炭粉在氧气中不完全燃烧生成一氧化碳,放出110.35kJ热量,即1mol炭粉在氧气中不完全燃烧生成一氧化碳,放出110.35kJ热量,热化学方程式为:C(s)+$\frac{1}{2}$O2 (g)=CO(g)△H=-110.35 kJ•mol-1,故答案为:C(s)+$\frac{1}{2}$O2 (g)=CO(g)△H=-110.35 kJ•mol-1
(5)煤通过途径Ⅱ作为燃料的意义是固体煤经处理变为气体燃料后,不仅在燃烧时可以大大减少SO2和烟尘对大气造成的污染,而且燃烧效率高,放热多,污染小.
故答案为:燃料燃烧充分,利用率高,放热多,污染小等.
点评 本题主要考查盖斯定律、反应热的有关计算、热化学方程式的书写,难度中等,注意盖斯定律的理解与热化学方程式的书写.


科目:高中化学 来源: 题型:选择题
| A. | c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-) | |
| B. | c(HRO3-)+c(RO32-)+c(OH-)=c(H+)+c(Na+) | |
| C. | c(Na+)=c(HRO3-)+c(H2RO3)+c(RO32-) | |
| D. | 两溶液中c(Na+)、c(HRO3-)、c(RO32-)分别相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
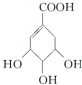 (提示:环丁烷
(提示:环丁烷 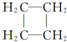 可简写成
可简写成  )
)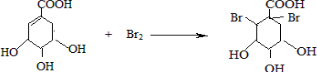
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由 M 与其它元素形成的 1:1 型化合物一定是共价化合物 | |
| B. | XZ2 分子中含有非极性共价键 | |
| C. | 原子半径:W>Z>Y>X>M | |
| D. | 工业上常用电解法制备 W 的单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部 | B. | ①②⑤⑥ | C. | ②⑤ | D. | ①⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 78 g Na2O2晶体中所含阴、阳离子个数均为4NA | |
| B. | 3.4 g氨气中含有0.6NA个N-H键 | |
| C. | Na2O2的电子式为: | |
| D. | PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com