
(17分)合成氨工业对国民经济和社会发展具有重要的意义。其原理为:N2(g)+3H2(g)  2NH3(g) △H= -92.4 kJ/mol,据此回答以下问题:
2NH3(g) △H= -92.4 kJ/mol,据此回答以下问题:
(1)合成氨工业采取的下列措施中,不能用勒沙特列原理解释的是 (填序号)。
①反应压强为20Mpa~50Mpa
②500℃的高温
③铁触媒作催化剂
④将生成的氨液化并及时从体系中分离出来,未反应的N2、H2循环到合成塔中。
(2)一定条件下NH3的平衡体积分数随n(N2)变化如图所示(T-温度)。则T2 T1(填>、=、<),
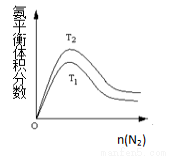
判断的依据是: 。(3分)
(3)合成氨气所需的氢气可以由水煤气分离得到。
涉及反应信息如下:
反应一:C(s)+H2O(g)  H2(g)+CO(g) 平衡常数K1
H2(g)+CO(g) 平衡常数K1
反应二:CO(g)+H2O(g)  H2(g)+CO2(g) 平衡常数K2
H2(g)+CO2(g) 平衡常数K2
① K1的表达式:K1= 。(3分)
②将一定量的H2O(g)和CO(g)分别通入到体积为1L的密闭容器中,在不同条件下进行反应,得到以下三组数据:
实验组别 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | H2 | CO | |||
1 | 650 | 1 | 2 | 0.8 | 1.2 | 5 |
2 | 900 | 0.5 | 1 | 0.2 | 0.8 | 3 |
3 | T | a | b | c | d | t |
(Ⅰ)实验1中,用CO2表示反应开始到平衡的平均反应速率为 。
(Ⅱ)在实验3,当a=0.5、b=1时,要使c、d数据与实验2相同,且t<3,可以采取的措施为 (填序号)(3分)
A.其它条件不变温度T<900℃ B.其它条件不变温度T>900℃
C.充入一定量氖气 D.使用高效催化剂
(Ⅲ)对于反应二,当升高温度时K2 (填“增大”、“减小”或“不变”)。
(1)②③(2分)
(2)T2<T1(2分)合成氨反应是放热反应,温度升高,平衡向逆反应方向移动,NH3的体积分数下降,所以T2<T1(3分)
(3)①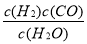 ;(3分) ②(Ⅰ)0.16mol·L-1·min-1;(2分)
;(3分) ②(Ⅰ)0.16mol·L-1·min-1;(2分)
(Ⅱ)D;(3分) (Ⅲ)减小(2分)
【解析】
试题分析:(1)①反应压强为20Mpa~50Mpa,增大压强,平衡向着正向移动,所以能够用勒夏特列原理解释,故①错误;②500℃的高温,升高温度平衡向着吸热方向移动,该反应放热,升高温度,向着逆向移动,不能够用勒夏特列原理解释,故②正确;③铁触媒作催化剂,可以加快反应速率,化学平衡不一定,所以③不能用勒夏特列原理解释,故③正确;④将生成的氨液化并及时从体系中分离出来,未反应的N2、H2循环到合成塔中,减少生成物,平衡向着正向移动,④能够用勒夏特列原理解释,故④错误;故选②③;(2)由于合成氨反应是放热反应,温度升高,平衡向逆反应方向移动,NH3的体积分数下降,所以T1>T2,
故答案为:T2<T1;合成氨反应是放热反应,温度升高,平衡向逆反应方向移动,NH3的体积分数下降,所以T1>T2;(3)C(s)+H2O(g) H2(g)+CO(g)反应中,C是固体,所以该反应的平衡常数K1=
H2(g)+CO(g)反应中,C是固体,所以该反应的平衡常数K1=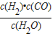 ,故答案为:
,故答案为: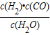 ;②(Ⅰ)v(CO2)=
;②(Ⅰ)v(CO2)=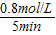 =0.16mol/(L?min),故答案为:0.16mol?L-1?min-1;
=0.16mol/(L?min),故答案为:0.16mol?L-1?min-1;
(Ⅱ)实验3要达到与实验2等效的平衡状态,但到达平衡的时间短,故采取的措施要使得反应速率快,但平衡不移动,所以D正确,故选D;(Ⅲ)由实验1、2,利用等效平衡判断该反应为放热,升高温度,平衡向吸热的方向移动即逆向移动,所以平衡常数减小,故答案为:减小.
考点:勒沙特列原理,平衡移动,化学平衡常数,等效平衡,化学平衡图像的分析。


科目:高中化学 来源:2015届甘肃省高三第一次诊断考试化学试卷(解析版) 题型:选择题
在1 L溶液中含有Fe(NO3)3和H2SO4两种溶质,其浓度分别为0.2 mol?L-1和1.5 mol?L-1,现向该溶液中加入39.2 g铁粉使其充分反应。下列有关说法正确的是
A.反应后溶液中Fe3+物质的量为0.8 mol
B.反应后产生13.44 L H2(标准状况)
C.反应后溶液中Fe2+和Fe3+物质的量之和为0.9 mol
D.由于氧化性Fe3+>H+,故反应中先没有气体产生后产生气体
查看答案和解析>>
科目:高中化学 来源:2015届甘肃省天水市高三上学期期中考试化学试卷(解析版) 题型:实验题
(20分)在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。 应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。
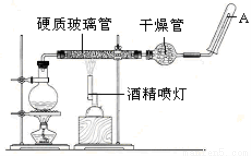
请回答该实验中的问题。
(1)写出该反应的反应方程式: ;并指明该氧化还原反应的还原剂是 ,氧化剂是 。
(2)实验前必须对整套装置进行气密性检查,操作方法是 。
(3)圆底烧瓶中盛装的水,该装置受热后的主要作用是 ;烧瓶底部放置了几片碎瓷片,碎瓷片的作用是 。
(4)干燥管中盛装是的物质是 ,作用是 。
(5)试管中收集气体是 ,如果要在A处玻璃管处点燃该气体,则必须对该气体进行 。
查看答案和解析>>
科目:高中化学 来源:2015届甘肃省天水市高三上学期期中考试化学试卷(解析版) 题型:选择题
某溶液中只可能含有下列离子中的几种(不考虑溶液中含的较少的H+和OH-):Na+、NH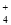 、SO
、SO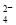 、CO
、CO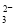 、NO
、NO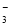 。取200 mL该溶液,分为等体积的两份分别做下列实验。实验1:第一份加入足量的烧碱并加热,产生的气体在标准状况下为224 mL。实验2:第二份先加入足量的盐酸,无现象,再加入足量的BaCl2溶液,得固体2.33 g。下列说法正确的是 ( )
。取200 mL该溶液,分为等体积的两份分别做下列实验。实验1:第一份加入足量的烧碱并加热,产生的气体在标准状况下为224 mL。实验2:第二份先加入足量的盐酸,无现象,再加入足量的BaCl2溶液,得固体2.33 g。下列说法正确的是 ( )
A.该溶液中一定含有Na+,且c(Na+)≥0.1 mol·L-1
B.该溶液中可能含有Na+
C.该溶液中一定不含NO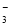
D.该溶液中肯定含有NH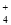 、SO
、SO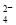 、CO
、CO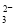 、NO
、NO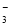
查看答案和解析>>
科目:高中化学 来源:2015届甘肃省天水市高三上学期期中考试化学试卷(解析版) 题型:选择题
下列有关实验装置进行的相应实验,能达到实验目的是( )
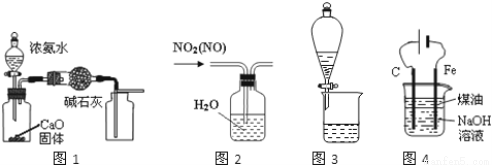
A.用图1装置制取并收集干燥纯净的NH3
B.用图2所示装置可除去NO2中的NO
C.用图3所示装置可分离CH3COOC2H5和饱和碳酸钠溶液
D.用图4装置制备Fe(OH)2并能较长时间观察其颜色
查看答案和解析>>
科目:高中化学 来源:2015届甘肃省天水市高二上学期期中考试化学(理)试卷(解析版) 题型:选择题
将pH=3的盐酸a L分别与下列三种溶液混合后,混合液均呈中性:
①1×10-3 mol·L-1的氨水b L
②c(OH-)=1×10-3 mol·L-1的氨水c L
③c(OH-)=1×10-3 mol·L-1的Ba(OH)2溶液d L
其中a、b、c、d的关系正确的是
A.b>a=d>c B.a=b>c>d
C.a=b>d>c D.c>a=d>b
查看答案和解析>>
科目:高中化学 来源:2015届甘肃省天水市高二上学期期中考试化学(理)试卷(解析版) 题型:选择题
草酸(H2C2O4)是二元弱酸,草酸氢钠溶液显酸性。常温下向10mL 0.01mol/L NaHC2O4溶液中滴加0.01mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是
A.V(NaOH) = 0时,c(H+)=1×10—2mol/L
B.V(NaOH) <10mL时,一定存在c(Na+)=c(C2O42-)+c(HC2O4- -)
C.V(NaOH) = 10 mL时,c(H+) = 1×10—7 mol/L
D.V(NaOH)>10 mL时,c(Na+)>c(C2O42-)>c(HC2O4-)
查看答案和解析>>
科目:高中化学 来源:2015届甘肃省天水市高二上学期期中考试化学(文)试卷(解析版) 题型:选择题
甲醛易溶于水,常温下有刺激性气味,当温度超过20℃时,挥发速度加快。室内装潢和家具挥发出来的甲醛是室内空气的主要污染物。根据甲醛的这些性质,下列做法错误的是
A.人住前,房间内保持一定温度并通风
B.紧密门窗一段时间后入住
C.请环境监测部门检测室内甲醛含量,低于国家标准后才可入住
D.装修尽可能选择在温度较高的季节
查看答案和解析>>
科目:高中化学 来源:2015届甘肃省天水市高三上学期第一学段考试化学试卷(解析版) 题型:选择题
下列说法正确的是
①正常雨水的pH为7.0,酸雨的pH小于7.0;②严格执行机动车尾气排放标准有利于防止大气污染;③使用二氧化硫和某些含硫化合物进行增白的食品会损害人体健康;④使用氯气对自来水消毒过程中,生成的有机氯化物可能对人体有害;⑤食品厂产生的含丰富氮、磷营养素的废水可长期排向养鱼水库。
A.①②③ B.①④⑤ C.②③④ D.③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com