
【题目】下列说法正确的是( )
A.Li是最活泼金属,F是最活泼非金属
B.稀有气体原子的最外层电子数都为8
C.元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16纵行
D.X2+的核外电子数目为10,则X在第三周期第ⅡA族
科目:高中化学 来源: 题型:
【题目】铁、铝的混合物进行如下实验:
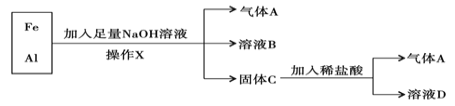
(1)操作X的名称是 ;
(2)气体A是 (填化学式);
(3)A与Cl2混合光照可能发生爆炸,生成 (填化学式),A在该反应中作为 (填“氧化剂”或“还原剂”);
(4)溶液B中阴离子除OH- 外还有________________ (填离子符号),溶液D中存在的金属离子为________________________ (填离子符号);
(5)加入足量NaOH溶液时发生反应的离子方程式为:_____________________;加入稀盐酸发生反应的离子方程式为: ___________________________;
(6)向溶液D加入NaOH溶液,观察到产生的白色絮状沉淀迅速变为灰绿色,最终变为红褐色,请写出沉淀转化的化学方程式:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既是氧化还原反应,又是吸热反应的是
A.灼热的炭与CO2反应 B.铝片与稀硫酸反应
C.Ba(OH)2·8H2O与NH4Cl的反应 D.甲烷在O2中的燃烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.实验室需要0.1 mol·L-1NaOH溶液500mL。根据溶液的配制情况回答下列问题。
(1)在下图所示仪器中,配制上述溶液肯定不需要的是_________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是 。
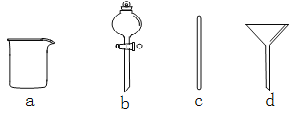
(2)配制时,其正确的操作顺序是(用字母表示,每个操作只用一次)__________。
A.用少量水洗涤烧杯2次~3次,洗涤液均注入容量瓶,振荡
B.在盛有NaOH固体的烧杯中加入适量水溶解
C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1 cm~2 cm处
(3)实验两次用到玻璃棒,其作用分别是:先用于__________、后用于__________。
(4)关于容量瓶的四种叙述:①是配制准确浓度溶液的仪器;②不宜贮存溶液;③不能用来加热;
④使用之前要检查是否漏水。这些叙述中正确的是( )
A.①②③④ B.②③ C.①②④ D.②③④
(5)根据计算用托盘天平称取的质量为 g。
Ⅱ.若配制1mol/L的稀硫酸溶液500mL
(6)则需要质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为___________mL(计算结果保留一位小数)。如果实验室有10mL 、25mL、50mL量筒,应选用_____________mL规格的量筒最好。
(7)下面操作造成所配稀硫酸溶液浓度偏高的是
A.溶解后溶液没有冷却到室温就转移
B.转移时没有洗涤烧杯、玻璃棒
C.向容量瓶加水定容时眼睛俯视液面
D.用量筒量取浓硫酸后洗涤量筒并把洗涤液转移到容量瓶
E.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法错误的是( )
A. 若1 mol·L-1 HF溶液中H+数目为NA,则等体积的2 mol·L-1 HF溶液中H+数目为2NA
B. 44 g CO2、N2O组成的混合气体中所含有的原子数为3NA
C. 36 g 3H2中含有的中子数目为24NA
D. 2.24 L O2与钠反应时,转移电子数目可能为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.电解质的导电过程是化学变化,而金属的导电是物理变化
B.电解质溶液导电的过程,就是电解质被电解的过程
C.电解质在任何条件下均可以导电
D.电解质溶液导电过程中一定有新物质生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨是人类科学技术上的一项重大突破,其反应原理为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1。一种工业合成氨的简式流程图如下:
2NH3(g) ΔH=-92.4 kJ·mol-1。一种工业合成氨的简式流程图如下:
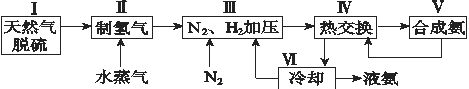
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:_______________。
(2)步骤Ⅱ中制氢气的原理如下:
①CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
②CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
对于反应①,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是 __。
利用反应②,将CO进一步转化,可提高H2的产量。若1 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18 mol CO、CO2和H2的混合气体,则CO的转化率为____________。
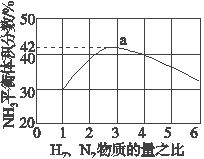
(3)如图表示500 ℃、60.0 MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:______________。
(4)上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号)_____________。简述本流程中提高合成氨原料总转化率的方法:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
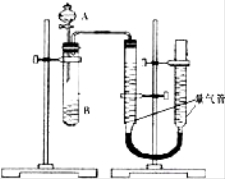
【题目】甲、乙两个小组利用酸性KMnO4与H2C2O4溶液反应,设计实验探究影响反应速率的因素(2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2+8H2O)
甲组:利用如图装置,通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小.(实验中所用KMnO4溶液均已加入H2SO4)
序号 | A溶液 | B溶液 |
① | 2ml 0.2mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液 |
② | 2ml 0.1mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液 |
③ | 2ml 0.2mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液和少量MnSO4 |
(1)该实验的目的是探究________________对化学反应速率的影响.
(2)分液漏斗中A溶液应该_____________加入(填“一次性”或“逐滴滴加”)
(3)实验结束后,读数前为了使两个量气管的压强相等,避免产生压强差,影响测定结果,需要进行的操作是____________________.
乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率为了探究KMnO4与H2C2O4浓度对反应速率的影响,某同学在室温下完成以下实验
实验编号 | 1 | 2 | 3 | 4 |
水/ml | 10 | 5 | 0 | X |
0.5mol/L H2C2O4/ml | 5 | 10 | 10 | 5 |
0.2mol/L KMnO4/ml | 5 | 5 | 10 | 10 |
时间/s | 40 | 20 | 10 | ﹣﹣﹣ |
(4)X=____________
A.5 B.10 C.15 D.20
4号实验中始终没有观察到溶液褪色,你认为可能的原因是____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论不正确的是( )
A.由C(s,石墨)═C(s,金钢石) △H>0可知,金刚石比石墨稳定
B.CO(g)燃烧热是283.0kJmol﹣1,则2CO2(g)═2CO(g)+O2(g)△H=+566.0kJmol﹣1
C.CH4(g)+2O2(g)═CO2+2H2O(I)△H<0,该反应的化学能可以转化为电能
D.已知C(s)+O2(g)═CO2(g)△H1,C(s)+![]() O2(g)═CO(g)△H2,则△H1<△H2
O2(g)═CO(g)△H2,则△H1<△H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com