
| A. | 0.24 mol/(L•min) | B. | 0.08 mol/(L•min) | C. | 0.06 mol/(L•min) | D. | 0.12 mol/(L•min) |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
 室温下,将0.10mol•L-1的盐酸滴入20mL0.10mol•L-1的氨水中,溶液的pH和pOH随加入盐酸体积变化的曲线如图所示.已知:pOH=-lg c(OH-),下列说法正确的是( )
室温下,将0.10mol•L-1的盐酸滴入20mL0.10mol•L-1的氨水中,溶液的pH和pOH随加入盐酸体积变化的曲线如图所示.已知:pOH=-lg c(OH-),下列说法正确的是( )| A. | M点所示的溶液中c(NH4+)+c(NH3•H2O)=c(Cl-) | |
| B. | Q点所示的溶液中c(NH4+)>c(Cl-)>c(H+)=c(OH-) | |
| C. | N点所示的溶液中c(NH4+)=c(Cl-) | |
| D. | M点和N点所示的溶液中水的电离程度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
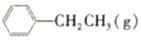 ?
?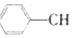 =CH2(g)+H2(g)
=CH2(g)+H2(g)| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(乙苯)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
| n(苯乙烯)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
| A. | 保持其他条件不变,向容器中充入不参与反应的水蒸气作为稀释剂,则乙苯的转化率大于50.0% | |
| B. | 反应在前20分钟的平均速率为v(H2)=0.008molmol/( L•min) | |
| C. | 若混合气体的平均摩尔质量不再变化,则说明反应已达到平衡状态 | |
| D. | 相同温度下,起始时向容器中充入0.10mol乙苯、0.10mol苯乙烯和0.30molH2,达到平衡前v正>v逆 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上生产玻璃、水泥均需要用石灰石做原料 | |
| B. | 双氧水、高锰酸钾溶液可以杀灭病毒,其消毒原理与二氧化硫漂白丝织物原理相同 | |
| C. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| D. | 石油分馏、煤的干馏、海水晒盐、从菜籽中提取菜籽油等过程都是物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)=0.1 mol•L-1的溶液:Na+、NH4+、SO42-、S2O32- | |
| B. | 使pH试纸显蓝色的溶液:Cu2+、NO3-、Fe3+、SO42- | |
| C. | 与铝粉反应放出H2的无色溶液:NO3-、Al3+、Na+、SO42- | |
| D. | 常温下$\frac{c({H}^{-})}{c(O{H}^{-})}$=1×10-12的溶液:K+、AlO2-、CO32-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com