
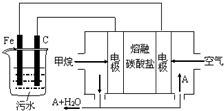
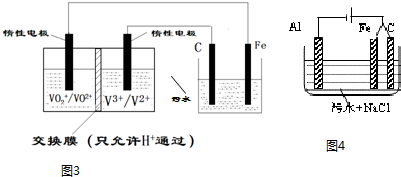
 电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示.下列说法正确的是( )
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示.下列说法正确的是( )| A. | 该燃料电池是以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,则负极的电极反应是CH4+4CO32--8e-═5CO2+2H2O | |
| B. | 实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣,此时,可以向污水中加入适量的稀H2SO4 | |
| C. | 实验过程中,若阴极产生2mol气体,则燃料电池消耗11.2L CH4 | |
| D. | 为了使该电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A参加循环,则A物质是CO32- |
分析 燃料电池中,正极发生的反应是氧气得电子被还原的过程,负极发生的反应是燃料失电子被氧化的过程;电池是以熔融碳酸盐为电解质,可以循环利用的物质只有二氧化碳,甲烷燃料电池中,负极发生的反应是甲烷失电子被氧化的过程,电极反应式为CH4+4CO32--8e-=5CO2+2H2O,所以电解时铁作阳极,因此主要发生Fe-2e-=Fe2+,阴极上氢离子得电子生成氢气,据此进行分析.
解答 解:燃料电池中,正极发生的反应是氧气得电子被还原的过程,负极发生的反应是燃料失电子被氧化的过程;电池是以熔融碳酸盐为电解质,可以循环利用的物质只有二氧化碳,甲烷燃料电池中,负极发生的反应是甲烷失电子被氧化的过程,电极反应式为CH4+4CO32--8e-=5CO2+2H2O,所以电解时铁作阳极,因此主要发生Fe-2e-=Fe2+,阴极上氢离子得电子生成氢气,
A.甲烷燃料电池中,负极发生的反应是甲烷失电子被氧化的过程,电极反应式为:CH4+4CO32--8e-=5CO2+2H2O,故A正确;
B.沉降的原理是碱性环境下,让铁离子沉淀,若加入硫酸,则铁离子不会产生沉淀,无法达到实验目的,故B错误;
C.电解时阴极反应式为2H++2e-=H2↑,产生4.48 L气体为标准状况下时,转移电子数为0.2mol,甲烷燃料电池中,负极发生的反应是甲烷失电子被氧化的过程,电极反应式为CH4+4CO32--8e-=5CO2+2H2O,则燃料电池消耗甲烷体积为:$\frac{0.2}{8}$×22.4L=0.56L,故C错误;
D.电池是以熔融碳酸盐为电解质,可以循环利用的物质只有二氧化碳,使该燃料电池长时间稳定运行,电池工作时必须 有部分A物质参加循环.A物质是CO2,故D错误;
故选A.
点评 本题考查原电池和电解池工作原理,较为综合,题目难度中等,做题时注意利用守恒的思考去解答,同时注意电极反应式的书写方法,试题培养了学生的分析能力及灵活应用能力.


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:选择题
| A. | 铜片加入FeCl3溶液中:Cu+2Fe3+═2Fe2++Cu2+ | |
| B. | 盐酸中加入Ca CO3:CO32-+2H+═H2O+CO2↑ | |
| C. | Na2O2与H2O反应:Na2O2+H2O═2Na++2OH-+O2↑ | |
| D. | 向Fe(OH)2中加入足量稀硝酸:Fe(OH)2+2H+═Fe2++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
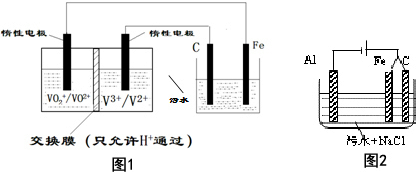
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
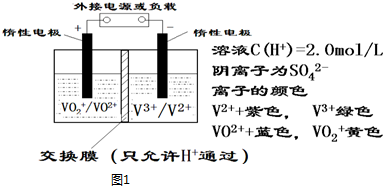
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F 是短周期元素组成的中学常见的物质,它们的转化关系如图所示(部分反应条件略去):
A、B、C、D、E、F 是短周期元素组成的中学常见的物质,它们的转化关系如图所示(部分反应条件略去): .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
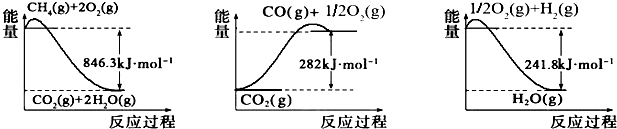
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2014年德美科学家因开发超分辨率荧光显微镜获诺贝尔化学奖,使光学显微镜分辨率步入了纳米时代.利用此类光学显微镜可以观察活细胞内蛋白质等大分子 | |
| B. | 能量是可以互相转化的.植物的光合作用可将太阳能转变成化学能,单晶硅可将光能转变成电能.原电池和电解池可实现化学能和电能的相互转换 | |
| C. | 分类方法、统计方法、定量研究、实验方法和模型化方法等是化学研究的常用方法 | |
| D. | 利用外接直流电源保护铁质建筑物,属于电化学中牺牲阳极的阴极保护法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com