
W、M、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。W的一种核素在考古时常用来鉴定一些文物的年代;M的氧化物是导致酸雨的主要物质之一。X的某一种单质在高空大气层中保护人类免遭太阳光中紫外线强烈侵袭;Y的基态原子核外有6个原子轨道处于半充满状态;Z能形成红色的Z2O和黑色的ZO两种氧化物。
(1)Y3+基态的电子排布式可表示为 。
(2)M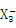 的空间构型 (用文字描述)。
的空间构型 (用文字描述)。
(3)M可形成多种氢化物,其中MH3的碱性强于M2H4的原因是_________________。
(4)根据等电子原理,WX分子的结构式为 。
(5)1 mol WX2中含有的σ键数目为 。
(6)H2X分子中X原子轨道的杂化类型为 。
(7)向Z2+的溶液中加入过量NaOH溶液,可生成Z的配位数为4的配位离子,写出该配位离子的结构式 。
【答案】(1)1s22s22p63s23p63d3;(2)平面正三角形;(3)N2H4分子中N为-2价,而NH3分子中N为-3价,电负性更高,导致N原子的孤对电子更易提供出来与H+结合;(4)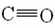 ;(5)2NA;(6)sp3杂化;(7)
;(5)2NA;(6)sp3杂化;(7)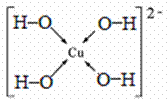 或
或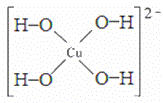
【解析】本题考查了元素推断,核外电子排布,空间构型的判断,等电子体的性质,化学键的判断,杂化类型的判断,配位离子的结构式的书写等知识。W的一种核素在考古时常用来鉴定一些文物的年代,故W为C元素,M的氧化物是导致酸雨的主要物质之一,则M为N元素,X的某一种单质是大气污染物监测物之一,则X是O元素;Y的基态原子核外有6个原子轨道处于半充满状态,则Y的价电子排布为3d54s1,故Y为Cr元素,Z能形成红色的Z2O和黑色的ZO两种氧化物,故Z为Cu元素。
(1)由上述推断可知,Y3+为Cr3+,基态的电子排布式可表示为1s22s22p63s23p63d3。
(2)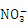 离子中,N的σ键为3,孤对电子数为(5+1-3×2)=3,所以
离子中,N的σ键为3,孤对电子数为(5+1-3×2)=3,所以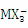 的空间构型为平面正三角形。
的空间构型为平面正三角形。
(3)从化合价角度分析:N2H4分子中N为-2价,而NH3分子中N为-3价,负电性更高,导致N原子的孤对电子更易提供出来与H+结合,故碱性更强。
(4)CO与氮气是等电子体,化学结构相似,所以CO的结构式类似于氮气,存在叁键结构,故CO为 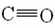 。
。
(5)CO2分子中存在2个碳氧双键,每个双键都有1个σ键,故1molCO2分子中存在2NA个σ键。
(6)H2O分子中,O的σ键数为2,孤对电子数为 (6-2)=2,故H2X分子中X原子轨道的杂化类型为sp3杂化。
(7)向Cu2+加入过量NaOH溶液,可生成四羟基合铜络离子,结构式为
 或
或


科目:高中化学 来源: 题型:
元素R的质量数为A,Rn﹣的核外电子数为x,则ngRn﹣所含中子的物质的量为( )
A. (A﹣x+n)mol B. (A﹣x﹣n)mol C. (A﹣x+n)n/Amol D. (A﹣x﹣n)n/Amol
查看答案和解析>>
科目:高中化学 来源: 题型:
在pH=1的溶液中,可以大量共存的离子是( )
A.K + 、Na + 、 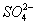 、
、 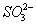 B.
B. 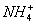 、Mg 2+ 、
、Mg 2+ 、 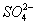 、Cl -
、Cl -
C.Na + 、K + 、 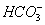 、Cl - D.K + 、Na + 、
、Cl - D.K + 、Na + 、 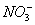 、
、 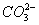
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)已知下列反应在一定条件下可以发生:
H 2 O 2 +2Fe 2+ +2H + ====2Fe 3+ +2H 2 O
H 2 O 2 +2Fe 3+ ====2Fe 2+ +O 2 ↑+2H +
(1)在以上反应中Fe 2+ 实际上起着_________作用,总反应式为____________________。
(2)I 2 也与Fe 2+ 一样发生上述类似反应,类比(1)在下面填入配平的合适的化学反应方程式:H 2 O 2 +I 2 ====2HIO
__________________________________。
总反应式为__________________________________。
(3)在H 2 SO 4 和KI的混合溶液中加入足量的H 2 O 2 ,放出大量的无色气体,溶液呈棕色,并可以使淀粉变蓝。有学生认为该反应的离子方程式为:H 2 O 2 +2I - ====I 2 +O 2 ↑+2H + ,这个方程式正确吗?__________________________________。
若正确,理由是(若认为不正确,该步不必作答)__________________。
若不正确,原因是(若认为正确,该步不必作答)__________________,并写出正确的化学反应方程式为(若是离子反应,写出离子反应式,没有离子反应的,写出化学反应方程式):_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,向10 mL0.1 mol·L-1的HCl溶液中逐滴加入0.1 mol·L-1的NH3·H2O溶液,其pH逐渐增大,图中a、b、c三点的pH为实验所测得。下列有关说法中一定错误的是
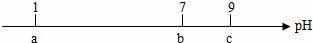
A.常温下,0.1 mol·L-1的HCl溶液的pH=1
B.当pH=7时,所加NH3·H2O溶液的体积大于10 mL
C.当7<pH<9时,溶液中c(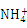 )>c(Cl-)
)>c(Cl-)
D.继续滴加0.1 mol·L-1的NH3·H2O溶液,溶液的pH最终可以变化至13
查看答案和解析>>
科目:高中化学 来源: 题型:
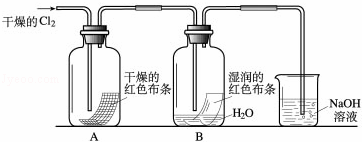
为了探究HClO的漂白性,某同学设计了如下的实验.
(1)通入Cl2后,从集气瓶A中干燥的红色布条的现象可得出的结论是 ;从集气瓶B中湿润的红色布条的现象可得出的结论是 .
(2)为了确证是HClO使湿润的红色布条褪色,你认为还应增加的实验是 .
(3)烧杯中溶液所起的作是 .
(4)为保证实验安全,当氯气以每分钟1.12L(标准状况)的流速匀速通入时,若实验需耗时4分钟,小烧杯中盛2mol•L﹣1的NaOH溶液的体积至少应为多少?(写出计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com