
| A. | NaOH | B. | NH3•H2O | C. | CuO | D. | Cu(OH)2 |
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| A | 配制100mL1.0mol/LCuSO4溶液 | 将25g CuSO4•5H2O溶于100mL蒸馏水中 |
| B | 除去CuO中混有的Al2O3 | 加入过量NaOH溶液后,过滤、洗涤、干燥 |
| C | 证明氧化性:H2O2>Fe3+ | 强硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 |
| D | 证明非金属性:Cl>C | 向NaHCO3溶液中加入过量盐酸振荡、静置、观察 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用乙醇萃取溴水中的溴单质 | |
| B. | 用干燥的pH试纸测定新制氯水的pH | |
| C. | 向NH4Cl溶液中滴加石蕊试液,溶液变红,证明NH4Cl发生了水解反应 | |
| D. | 向蒸馏水中滴加过量的饱和FeCl3溶液,并不断搅拌,制取Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 若图中均为非氧化还原反应,当丁为一元强碱时,甲可能是NaAlO2 | |
| B. | 若图中均为非氧化还原反应,当丁为一元强酸时,甲可能是NaOH | |
| C. | 若图中均为氧化还原反应,当丁为非金属单质时,丙可能是NH3 | |
| D. | 若图中均为氧化还原反应,当丁为金属单质时,丙可能是FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:W>Z>X | |
| B. | X、Y、Z都能与W组成离子化合物 | |
| C. | X、Y组成的化合物可与W单质反应 | |
| D. | Q是Z、W组成的化合物,1molQ中约含有6.02×1023个阴离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
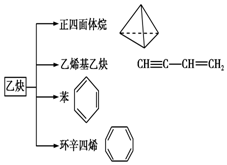 乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.请回答下列问题:
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.请回答下列问题: .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向某溶液中加入BaCl2溶液,产生白色沉淀,再加盐酸,沉淀不溶解,该溶液一定含有SO42- | |
| B. | 向某溶液中同时加入几滴KSCN溶液和少量新制氯水,溶液变为红色,该溶液一定含有Fe2+ | |
| C. | 向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的无色气体,该溶液不一定含有CO32- | |
| D. | 向某溶液中加入稀硝酸后,再加入AgNO3溶液,产生白色沉淀,则该溶液中含有Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入稀盐酸产生无色无味气体,将气体通入澄清石灰水中,溶液变浑浊,则原溶液中大量含有CO32- | |
| B. | 加入稀盐酸和氯化钡溶液,有白色沉淀产生,则原溶液中一定含有SO42- | |
| C. | 分别含有Mg2+、Cu2+和Na+的三种盐酸盐溶液,用NaOH溶液就能一次鉴别开 | |
| D. | 加硝酸银溶液后产生白色沉淀,再加盐酸,白色沉淀不消失,则原溶液中一定有Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇作为基本的有机化工产品和环保动力燃料具有广阔的应用前景,CO2 加氢合成甲醇是合理利用CO2的有效途径.由CO2制备甲醇过程可能涉及反应如下:
甲醇作为基本的有机化工产品和环保动力燃料具有广阔的应用前景,CO2 加氢合成甲醇是合理利用CO2的有效途径.由CO2制备甲醇过程可能涉及反应如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com