
 酱油是一种常用调味剂,根据国标要求酱油中NaCl的含量不应低于15g/100mL.莫尔法是较简单的一种测量Cl-含量的方法.现采用该法测量某市售酱油是否符合NaCl含量标准要求.实验原理如下(25℃):
酱油是一种常用调味剂,根据国标要求酱油中NaCl的含量不应低于15g/100mL.莫尔法是较简单的一种测量Cl-含量的方法.现采用该法测量某市售酱油是否符合NaCl含量标准要求.实验原理如下(25℃):分析 (1)根据配制步骤是计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶来分析需要的仪器;
(2)硝酸银见光易分解,要避光;滴定操作中,眼睛应该注视着锥形瓶中溶液的颜色变化;根据滴定原理:氯离子首先与银离子反应,然后重铬酸根离子与银离子反应解答;
(3)根据滴定管的结构和精确度以及测量的原理;
(4)根据Ag++Cl-═AgCl来计算稀释后的酱油中NaCl的浓度;根据稀释时溶质的物质的量不变求出原酱油中NaCl浓度,从而计算出NaCl含量,以判断是否合格.
解答 解:(1)样品稀释过程中,用移液管移取酱油样品,应在100 mL容量瓶中定容,还需用到的玻璃仪器有烧杯、玻璃棒、胶头滴管;
故答案为:移液管;100 mL容量瓶;烧杯、玻璃棒、胶头滴管;
(2)硝酸银见光易分解,要避光,所以标准硝酸银溶液用棕色滴定管盛装;滴定中眼睛应注视试剂瓶中颜色变化,出现砖红色沉淀,不再消失,说明氯离子完全反应,即达到滴定终点.
故答案为:硝酸银见光易分解;试剂瓶中颜色变化;砖红色沉淀,不再消失;
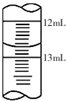
(3)滴定结束时,滴定管中液面如上图所示,则读数为12.70mL,故答案为:12.70mL;
(4)Ag++Cl-═AgCl↓
1 1
0.1000mol/L×12.50mL 10.00mL×C(Cl-)
解得:C(Cl-)=0.1250mol/L,即稀释后的酱油中NaCl的浓度为0.1250mol/L,
准确移取酱油样品5.00mL稀释至100mL,稀释后的酱油中NaCl的浓度为0.1250mol/L,则稀释前NaCl的浓度为$\frac{0.1250mol/L×100mL}{5.00mL}$=2.5mol/L,NaCl含量$\frac{2.5×58.5}{10}$g/100mL=14.625g/100mL,不符合标准;
故答案为:0.1250;不符合.
点评 本题综合考查物质的含量测定,涉及滴定原理,侧重分析能力、实验能力及计算能力的综合考查,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 X+CH2=CH-M$→_{碱}^{Pb}$
X+CH2=CH-M$→_{碱}^{Pb}$ CH═CH-M+HX(X为卤原子,M为烃基或含酯基的取代基等)
CH═CH-M+HX(X为卤原子,M为烃基或含酯基的取代基等)
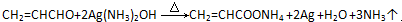 .
. .
.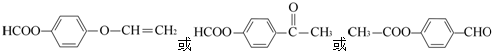 .
. )常用作香豆素的替代品,鉴别二氢香豆素和它的一种同分异构体(
)常用作香豆素的替代品,鉴别二氢香豆素和它的一种同分异构体(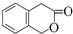 )需要用到的试剂有:NaOH溶液、稀硫酸、氯化铁溶液,
)需要用到的试剂有:NaOH溶液、稀硫酸、氯化铁溶液,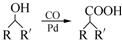 (R,R′为烃基),试写出以苯和丙烯(CH2=CH-CH3)为原料,合成
(R,R′为烃基),试写出以苯和丙烯(CH2=CH-CH3)为原料,合成 的路线流程图(无机试剂任选).合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{Na_{3}CH_{2}Br溶液}$CH3CH2OH.
的路线流程图(无机试剂任选).合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{Na_{3}CH_{2}Br溶液}$CH3CH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用广泛pH试纸测得Na2CO3溶液的pH为10.5 | |
| B. | 用10mL量筒量取5.20mL盐酸 | |
| C. | 用托盘天平称取25.20gNaCl | |
| D. | 用25mL的酸式滴定管量取14.80mL KMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
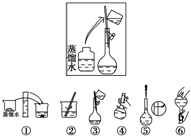 某同学帮助水质检测站配制500mL 0.5mol•L-1NaOH溶液以备使用.其操作步骤如图所示,则方框中操作的位置为( )
某同学帮助水质检测站配制500mL 0.5mol•L-1NaOH溶液以备使用.其操作步骤如图所示,则方框中操作的位置为( )| A. | ①与②之间 | B. | ②与③之间 | C. | ④与⑤之间 | D. | ⑤与⑥之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肯定不存在的离子是Fe3+、Cu2+、NH4+、SO42-、CO32- | |
| B. | 肯定存在的离子是Na+、K+、SO32-、Br- | |
| C. | 无法确定原溶液中是否存在Cl- | |
| D. | 若步骤④改用BaCl2溶液和盐酸的混合溶液,则对溶液中离子的判断无影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 84消毒液含有次氯酸钠,洁厕灵中含有盐酸,二者混合使用会产生氯气使人中毒 | |
| B. | 输送氯气的管道漏气,可以用浓氨水检验,是因为氯气和氨气发生化合反应生成氯化铵. | |
| C. | 因氯气消毒过的自来水不宜直接用来养金鱼,最好在阳光下晒一段时间 | |
| D. | 氯气和二氧化硫均有漂白性,二者按体积比1:1混合后不能是有色布条褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com