
| A、c(OH-)<c(H+)<c(B+)<c(A-) |
| B、c(OH-)=c(H+)+c(HA) |
| C、c(H+)+c(B+)<c(A-)+c(OH-) |
| D、c(A-)=c(B+)>c(H+)=c(OH-) |


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
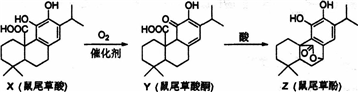
| A、X、Y、Z互为同系物 |
| B、X、Y、Z均能与FeCl3溶液发生显色反应 |
| C、1molZ与NaOH溶液反应最多消耗3molNaOH |
| D、1molY与浓溴水反应最多消耗3molBr2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、100mL 3mol/L盐酸与5.6g Fe充分反应转移0.3NA个电子 |
| B、标准状况下,22.4L乙醇中含有的碳原子数目为2NA个 |
| C、16g O2和O3的混合物中含有的氧原子数目为NA个 |
| D、0.05mol熔融的CaCl2中含有0.1NA个阳离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol N2H4 (g)的能量比1molN2(g)的能量高534KJ |
| B、1mol N2H4 (g)的能量比1molN2(g)的能量低534KJ |
| C、1mol N2H4 (g)与1molO2(g)的总能量和比1molN2(g)和2molH2O(g)的总能量和高534KJ |
| D、1mol N2H4 (g)与1molO2(g)的总能量和比1molN2(g)和2molH2O(g)的总能量和低534KJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 氧化 |
| 雨水 |
| 雨水 |
| 氧化 |
| A、若猜想一或猜想三正确,则该雨水加入盐酸后,再加入BaCl2溶液,有白色沉淀生成 |
| B、若存在猜想二的过程,则该雨水可能使品红褪色 |
| C、若只存在猜想一的过程,则该雨水的pH随时间延长而增大 |
| D、上述任意一个猜想正确,该地区雨水的pH均小于5.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 化石燃料开采和加工过程中常有硫化氢废气.工业上可用硫化氢制取氢气,分析化学上硫化氢溶液用作离子分组试剂.
化石燃料开采和加工过程中常有硫化氢废气.工业上可用硫化氢制取氢气,分析化学上硫化氢溶液用作离子分组试剂.| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com