
固态NH4Cl受热变成气体,气体遇冷又变为固态NH4Cl;固态碘受热变成蒸气,蒸气遇冷又变成固态碘,这两种现象的本质是否相同?请说明判断的理由。
★ ★★
判断下列说法是否正确,不正确的说明理由。
①氨气溶于水能导电,所以氨气是电解质。
②实验室用浓氨水与NaOH固体制取氨气。
③氨与酸反应生成铵盐,与挥发性酸相遇时能形成白烟。
④某晶体与NaOH共热放出一种使湿润的红色石蕊试纸变蓝的气体,该晶体中含有NH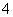 。
。
⑤氨水中含氮微粒中最多的微粒是NH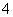 。
。
⑥把NH3通入稀HNO3中,当溶液的pH等于7时,是NH3和HNO3等物质的量反应。
⑦液氨作为清洁能源的反应原理是4NH3+5O2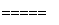 4NO+6H2O。
4NO+6H2O。
⑧氨水中物质的量浓度最大的粒子是NH3·H2O(除水外)。
⑨在1 mol·L-1氨水中,NH3·H2O、NH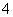 、NH3的物质的量浓度之和为1 mol·L-1。
、NH3的物质的量浓度之和为1 mol·L-1。
★ ★★


科目:高中化学 来源: 题型:
下列不属于配合物的是( )
A.[Cu(NH3)4]SO4·H2O
B.[Ag(NH3)2]OH
C.KAl(SO4)2·12H2O
D.Na[Al(OH)4]
查看答案和解析>>
科目:高中化学 来源: 题型:
答案 (1)× (2)× (3)× (4)× (5)√ (6)√
(7)× (8)√ (9)× (10)× (11)√ (12)×
解析 (1)氢键与氢有关但不属于化学键。
(2)可燃冰中水分子间存在氢键,但CH4与H2O之间不存在氢键。
(3)乙醇分子、水分子中都有—OH,符合形成氢键的条件。
(4)HI分子间只存在范德华力的作用。
(5)和(6)正确。
(7)H2与O2分子中的共价键均为非极性键,分子间只存在范德华力。
(8)H2O2分子中的H几乎成为“裸露”的质子,与水分子一样,H2O2分子间也存在氢键。
(9)卤素氢化物中,HF的熔、沸点最高。
(10)分子内氢键对物质的熔、沸点影响很小。
(11)在极性分子H2O2中存在非极性键。
(12)H2O比H2S稳定是O—H键键能大于S—H键键能,而与氢键无关。
★ ★★
查看答案和解析>>
科目:高中化学 来源: 题型:
有关物质结构的下列说法中正确的是( )
A.碘升华时破坏了分子间作用力
B.含极性键的共价化合物一定是电解质
C.氯化钠固体中的离子键在溶于水时被破坏
D.HF的分子间作用力大于HCl,故HF比HCl更稳定
★ ★★
查看答案和解析>>
科目:高中化学 来源: 题型:
答案 A
解析 本题考查氧化还原反应和阿伏加德罗定律及元素化合物知识,意在考查学生利用有关定律进行数据处理的能力。氮氧化合物与铜粉反应生成CuO和N2,结合题中气体体积和阿伏加德罗定律可推知该氮的氧化物分子中只含有一个氮原子,结合选项知A正确。
★ ★★
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室模拟合成氨和氨催化氧化的流程如下:
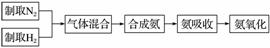

已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气。
(1)从图中选择制取气体的合适装置:氮气___________________________、
氢气______________。
(2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有________、____________________________。
(3)氨合成器出来经冷却的气体连续通入乙装置的水中吸收氨,________(“会”或“不会”)发生倒吸,原因是___________________________。
(4)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是______________________,
锥形瓶中还可观察到的现象是__________________________________。
(5)写出乙装置中氨氧化的化学方程式:__________________________________。
(6)反应结束后锥形瓶内的溶液中含有的离子为H+、OH-、________、________。
★ ★★
查看答案和解析>>
科目:高中化学 来源: 题型:
硝酸铜是制备Cu—Zn—Al系催化剂的重要原料,制取硝酸铜现有三种设计方案可供选用:
①Cu与稀硝酸反应制取:3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
②Cu与浓硝酸反应制取:Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O
③通氧气于铜屑与稀硝酸的体系中制取:2Cu+4HNO3+O2===2Cu(NO3)2+2H2O
下列说法正确的是( )
A.制取相同量的硝酸铜需硝酸的量③最多
B.制取相同量的硝酸铜①产生的有毒气体比②多
C.三种方案中硝酸的利用率③>①>②
D.三种方案的反应都可以在铁制容器中进行
★ ★★
查看答案和解析>>
科目:高中化学 来源: 题型:
比较下列微粒半径大小,用“>”或“<”填空
(1)Na________Mg________Cl
(2)Li________Na________K
(3)Na+________Mg2+________Al3+
(4)F-________Cl-________Br-
(5)Cl-________O2-________Na+________Mg2+
(6)Fe2+________Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
处于相邻两个周期的主族元素A、B、C、D,它们的原子半径依次变小;A离子和B离子的电子层相差两层,且能形成BA2型的离子化合物;C的离子带3个正电荷;D的气态氢化物通式为H2R,D在它的最高价氧化物中的质量分数是40%,原子核中有16个中子。试回答:
(1)写出A、B、C、D的元素符号:
A:________ B:________ C:________ D:________
(2)B、C、D的第一电离能从大到小的顺序如何排列?(写元素符号,下同)______。
(3)A、B、C的电负性从大到小的顺序如何排列?________________________。
(4)向D的氢化物的水溶液中滴入少量A的单质,发生什么现象?___________,写出有关反应的化学方程式:__________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com