
A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系:
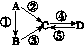
图G52
(1)若A是淡黄色固体,C、D是氧化物,C是造成酸雨的主要物质,但C也有其广泛的用途,写出其中的2个用途:__________________________。
(2)若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染。B与C在一定条件下反应生成的A是大气的主要成分,写出该反应的化学方程式:
__________________________________。
(3)若D物质具有两性,②、③反应均要用强碱溶液,④反应时通入过量的一种引起温室效应的主要气体。判断单质A的元素在周期表中的位置:__________________。
(4)若A是太阳能电池用的光伏材料。C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性。写出②反应的化学方程式:________________________________________________________________________。
D的化学式是______。
(5)若A是应用最广泛的金属。④反应用到A,②、⑤反应均用到同一种非金属单质。C的溶液用于蚀刻印刷铜电路板,写出该反应的离子方程式:________________________________________________________________________。
(1)漂白、杀菌、消毒、作为硫酸的原料等
(2)4NH3+6NO 5N2+6H2O
5N2+6H2O
(3)第三周期第ⅢA族
(4)Si+2NaOH+H2O===Na2SiO3+2H2↑ Na2CO3
(5)Cu+2Fe3+===Cu2++2Fe2+
[解析] (1)淡黄色的单质是硫,C为SO2,D为SO3,SO2的作用有漂白、杀菌,制备硫酸等。(2)A、B、C、D分别为N2、NH3、NO、NO2,B与C在一定条件下生成A的反应是归中反应。(3)中学阶段学习的两性物质有铝及铝的氧化物和氢氧化物,故铝元素的位置为第三周期第ⅢA族,要注意族的写法。(4)A为硅晶体,B、C、D分别为SiO2、Na2SiO3、Na2CO3。(5)A为金属铁,C为FeCl3,D为FeCl2。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
设NA 为阿伏伽德罗常数的值,下列说法正确的是( )
A.标准状况下,1.12 L CCl4含有C—Cl键的数目为0.2NA
B.标准状况下,2.24 L氯气中含有的 Cl数目一定为0.2NA
Cl数目一定为0.2NA
C.常温常压下,4.4 g CO2与N2O的混合气体中含有的原子总数为0.3NA
D.80 mL 10 mol·L-1盐酸与足量MnO2加热反应,产生的Cl2分子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨是人类科学技术上的一项重大突破,其反应原理为
N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1。
一种工业合成氨的简式流程图如下:

(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:________________________________________________________________________。
(2)步骤Ⅱ中制氢气的原理如下:
①CH4(g)+H2O(g)CO(g)+3H2(g)
ΔH=+206.4 kJ·mol-1
②CO(g)+H2O(g)CO2(g)+H2(g)
ΔH=-41.2 kJ·mol-1
对于反应①,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是____________。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2的产量。若1 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18 mol CO、CO2和H2的混合气体,则CO的转化率为____________。
(3)图(a)表示500 ℃、60.0 MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:____________。
(4)依据温度对合成氨反应的影响,在图(b)坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。


(a) (b)
(5)上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号)________。简述本流程中提高合成氨原料总转化率的方法:________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向苏打和小苏打溶液中分别加入盐酸 | 均冒气泡 | 两者均能与盐酸反应 |
| B | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3·H2O能大量共存 |
| C | 将可调高度的铜丝伸入到稀HNO3中 | 溶液变蓝 | Cu与稀HNO3发生置换反应 |
| D | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置 | 下层溶液 显紫红色 | 氧化性:Fe3+>I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质的性质和该性质的应用均正确的是( )
A.氯气具有酸性,可与烧碱或石灰乳反应制备含氯消毒剂
B.浓硫酸具有强氧化性,常温下可用铝罐盛装
C.氢氟酸具有弱酸性,可用氢氟酸雕刻玻璃
D.过氧化钠具有强氧化性,可用作潜水艇中氧气的来源
查看答案和解析>>
科目:高中化学 来源: 题型:
某气态有机物100mL最多可跟100mL氯化氢发生加成反应,生成氯代烷。每0.5mol的该有机物最多可跟1.5mol Cl2发生取代反应,该有机物结构简式是( )
A.CH≡CH
B.CH2===CH2
C.CH2===CH—CH===CH2
D.CH2===CHCl
查看答案和解析>>
科目:高中化学 来源: 题型:
现有CH4、C2H4、C2H6三种有机化合物:
(1)等质量的以上物质完全燃烧时耗去O2的量最多的是_______。
(2)同状况、同体积的以上三种物质完全燃烧时耗去O2的量最多的是________。
(3)等质量的以上三种物质燃烧时,生成二氧化碳最多的是_____,生成水最多的是________。
(4)在120 ℃、1.01×105 Pa时,有两种气态烃和足量的氧气混合点燃,相同条件下测得反应前后气体体积没有发生变化,这两种气体是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强。25 ℃时氯气氯水体系中存在以下平衡关系:
Cl2(g) Cl2(aq) K1=10-1.2
Cl2(aq) K1=10-1.2
Cl2(aq)+H2O HClO+H++Cl- K2=10-3.4
HClO+H++Cl- K2=10-3.4
HClO H++ClO- Ka=?
H++ClO- Ka=?
其中Cl2(aq)、HClO和ClO-分别在三者中占分数(α)随pH变化的关系如图所示 。下列表述正确的是( )

A.Cl2(g)+H2O 2H++ClO-+Cl- K=10-10.9
2H++ClO-+Cl- K=10-10.9
B.在氯处理水体系中,c(HClO)+c(ClO-)=c(H+)-c(OH-)
C.用氯处理饮用水时,pH=7.5时杀菌效果比pH=6.5时差
D.氯处理饮用水时,在夏季的杀菌效果比在冬季好
查看答案和解析>>
科目:高中化学 来源: 题型:
工业制硝酸的主要反应为
4NH3(g)+5O2(g)  4NO(g)+6H2O(g) ΔH。
4NO(g)+6H2O(g) ΔH。
(1)已知氢气的燃烧热为285.8 kJ/mol。
N2(g)+3H2(g)===2NH3(g) ΔH=-92.4 kJ/mol;
H2O(l)===H2O(g) ΔH=+44.0 kJ/mol;
N2(g)+O2(g)===2NO(g) ΔH=+180.6 kJ/mol。
则上述工业制硝酸的主要反应的ΔH=____________________。
(2)在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
浓度 时间 | c(NH3)(mol/L) | c(O2)(mol/L) | c(NO)(mol/L) |
起始 | 0.8 | 1.6 | 0 |
第2 min | 0.6 | a | 0.2 |
第4 min | 0.3 | 0.975 | 0.5 |
第6 min | 0.3 | 0.975 | 0.5 |
第8 min | 0.7 | 1.475 | 0.1 |
①反应在第2 min到第4 min时,O2的平均反应速率为__________________。
②反应在第6 min时改变了条件,改变的条件可能是__________(填序号)。
A.使用催化剂 B.升高温度
C.减小压强 D.增加O2的浓度
③下列说法中能说明4NH3(g)+5O2(g)4NO(g)+6H2O(g)达到平衡状态的是________(填序号)。
A.单位时间内生成n mol NO的同时,生成n mol NH3
B.条件一定,混合气体的平均相对分子质量不再变化
C.百分含量w(NH3)=w(NO)
D.反应速率v(NH3)∶v(O2)∶v(NO)∶v(H2O)=4∶5∶4∶6
E.恒压条件下,混合气体的密度不再变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com