
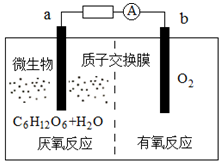
 微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法正确的是( )
微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法正确的是( )| A. | b极为正极,发生氧化反应 | |
| B. | 外电路中电子的移动方向为:b→a | |
| C. | 质子通过交换膜从b极区移向a极区 | |
| D. | 电池总反应为C6H12O6+6O2=6CO2+6H2O |
分析 A.根据图知,负极上C6H12O6失电子,正极上O2得电子和H+反应生成水;
B.电子从负极流向正极;
C.原电池中,阳离子向正极移动;
D.燃料电池反应式和燃料燃烧方程式相同.
解答 解:A.根据图知,负极上C6H12O6失电子,正极上O2得电子和H+反应生成水,所以a为负极发生氧化反应,b为正极发生还原反应,故A错误;
B.电子从负极流向正极,则外电路中电子的移动方向为:a→b,故B错误;
C.通过原电池的电极反应可知,负极区产生了H+,根据原电池中阳离子向正极移动,可知质子(H+)通过交换膜从a极区移向b极区,故C错误;
D.该反应属于燃料电池,燃料电池的电池反应式和燃烧反应式相同,则电池反应式为C6H12O6+6O2=6CO2+6H2O,故D正确;
故选D.
点评 本题考查化学电源新型电池,题目难度中等,正确判断电解质溶液酸碱性是解本题关键,所有原电池中都是负极上失电子发生氧化反应、正极上得电子发生还原反应,难点是电极反应式的书写.


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:解答题
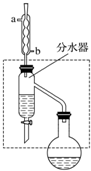 乙酸丁酯是重要的化工原料,具有水果香味.实验室制备乙酸丁酯的反应、装置示意图和有关信息如下:CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓H_{2}SO_{4}}$ CH3COOCH2CH2CH2CH3+H2O
乙酸丁酯是重要的化工原料,具有水果香味.实验室制备乙酸丁酯的反应、装置示意图和有关信息如下:CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓H_{2}SO_{4}}$ CH3COOCH2CH2CH2CH3+H2O| 乙酸 | 正丁醇 | 乙酸丁酯 | |
| 熔点/℃ | 16.6 | -89.5 | -73.5 |
| 沸点/℃ | 117.9 | 117 | 126.0 |
| 密度/g•cm-3 | 1.1 | 0.80 | 0.88 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表有7个主族,7个副族,1个零族,1个Ⅷ族,共16纵行 | |
| B. | X2+的核外电子数目为18,则X在第四周期第ⅡA族 | |
| C. | Li是最活泼金属,F是最活泼非金属 | |
| D. | NaOH碱性比KOH强 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 | 试剂及操作 | 现象 | |
| 试管 | 滴管 | ||
 1.0mL | 饱和Na2SlO3溶液(含2滴酚酞) | 先滴加1.0mL0.5mol•L-1NaOH溶液:再滴加1.5mL1.0mol•L-1H2SO4溶液 | Ⅰ.红色溶液中出现胶状沉淀 |
| 0.1mol•L-1AlCl3溶液 | Ⅱ.加碱时出现白色沉淀,又逐渐溶解直至消失;加酸时产生白色沉淀,又逐渐溶解直至消失 | ||
| 0.1mol•L-1Fe(NO3)2溶液 | Ⅲ.加碱时生成白色沉淀迅速变成灰绿色,最后变成红褐色;加酸后溶液变为黄色 | ||
| 新制饱和氯水 | Ⅳ.加碱时溶液变为无色;加酸后无色溶液变为浅黄绿色 | ||
| 实验 | 试剂及操作 | 现象 | |
| 试管 | 滴管 | ||
 1.0 mL | 0.1 mol•L-1 Fe(NO3)2溶液 | 先滴加1.5 mL 1.0 mol•L-1 H2SO4溶液; 再滴加1.0 mL 0.5 mol•L-1 NaOH溶液 | V.加酸时溶液无明显现象;加碱后溶液依然没有明显变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其他条件不变,增大该体系的压强,平衡正向移动,则C为气体 | |
| B. | 其他条件不变.若升高温度.B的平衡转化率增大.则该反应是放热反应 | |
| C. | 该反应的化学平衡常数表达式为K=$\frac{{c}^{4}(C)•{c}^{2}(D)}{{c}^{3}(A)•{c}^{2}(B)}$ | |
| D. | 此时.B的平衡转化率是40% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 燃料的脱硫脱氮、NO的催化转化都是减少酸雨产生的措施 | |
| B. | 利用稀硝酸清除铜镜表面的铜锈是因为稀硝酸具有强氧化性 | |
| C. | BaSO4难溶于水和强酸,在医学上常用作钡餐 | |
| D. | 食品包装中常放入有硅胶和铁粉的小袋,防止食物受潮和氧化变质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸酸与氢氧化钡反应 Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | 过量CO2通入NaOH溶液中 CO2+OH-=H CO3- | |
| C. | 硝酸银溶液中加入铜粉 Ag++Cu═Cu2++Ag↓ | |
| D. | 锌与稀硝酸反应 Zn+2H+═Zn2++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO、H2S的转化率之比为1:1 | |
| B. | 达平衡后H2S的体积分数为29.4% | |
| C. | 升高温度,COS浓度减小,表明该反应是吸热反应 | |
| D. | 恒温下向平衡体系中再加入CO、H2S、COS、H2各1 mol,平衡不移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
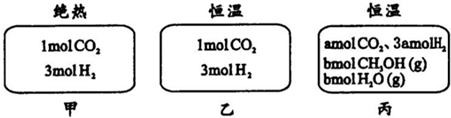
| A. | 刚开始反应时速率:甲<乙 | B. | 平衡后反应放热:甲>乙 | ||
| C. | 500℃下该反应平衡常数:K=3×102 | D. | 若a≠0,则0.9<b<l |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com