
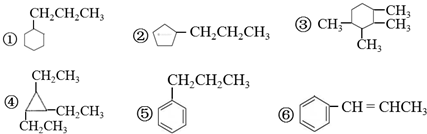
| A. | ①② | B. | ⑤⑥ | C. | ①④ | D. | ③④ |
分析 具有相同分子式、不同结构的化合物互为同分异构体,即:互为同分异构体的化合物满足两点:第一,分子式必须相同,第二,具有的结构不同,据此进行解答.
解答 解:A.①②分子中含有的C原子数不同,二者一定不属于同分异构体,故A错误;
B.⑤⑥中含有的碳原子数相同,但是⑥中多了碳碳双键,则⑤分子中H原子数比⑥多2,所以二者的分子式不同,一定不属于同分异构体,故B错误;
C.①④的分子式都是C9H18,二者的分子式相同,且结构不同,则二者互为同分异构体,故C正确;
D.③④分子中含有的C原子数分别为10、9,二者的分子式一定不同,故D错误;
故选C.
点评 本题考查了同分异构体的判断,题目难度不大,明确同分异构体的概念为解答关键,试题侧重基础知识的考查,培养了学生的分析能力及灵活应用能力.


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:解答题
 T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如表:
T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如表:| 元素 | 相关信息 |
| T | T元素可形成自然界硬度最大的单质 |
| W | W与T同周期,核外有三个未成对电子 |
| X | X原子的第一电离能至第四电离能分别是:I1=578kJ/mol,I2=1817kJ/mol,I3=2745kJ/mol,I4=11575kJ/mol |
| Y | 常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质 |
| Z | Z的一种同位素的质量数为63,中子数为34 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H6与C3H8没有同分异构体,CH2O2与C2H4O2属于同系物 | |
| B. | 一定条件下,完全燃烧14g含氧质量分数为a的乙烯、乙醛混合气体,则生成水的质量为18(1-a)g | |
| C. | 一定条件下,乙酸乙酯、淀粉、蛋白质、乙烯都能与水发生水解反应 | |
| D. | 全降解塑料(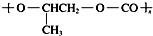 )可由单体环氧丙烷( )可由单体环氧丙烷(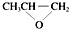 )和CO2缩聚制得 )和CO2缩聚制得 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
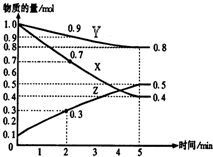 某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示.
某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ③⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
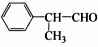 ,工业合成路线如下:
,工业合成路线如下: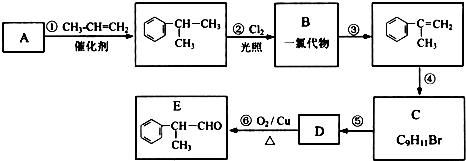
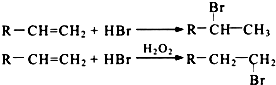 (R-代表烃基)
(R-代表烃基) 或
或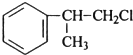 (任写一个),其官能团为氯原子.
(任写一个),其官能团为氯原子.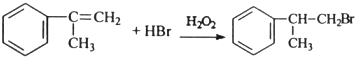 (必须有反应条件).
(必须有反应条件). .
.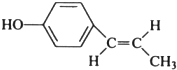 (只写反式结构).
(只写反式结构).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤中含有苯和甲苯,可用先干馏后分馏的方法将它们分离出来 | |
| B. | 含C18以上烷烃的重油经过催化裂化可以得到汽油 | |
| C. | 石油裂解主要目的是得到短链的不饱和烃 | |
| D. | 煤的气化与液化都是化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
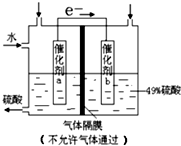
| A. | 该装置将化学能转化为电能,电流方向为b→a | |
| B. | 催化剂b表面O2发生还原反应,其附近酸性增强 | |
| C. | 催化剂a表面的反应:SO2+2H2O-2e-=SO42-+4H+ | |
| D. | 若得到的硫酸浓度仍为49%,则理论上参加反应的SO2与加入的H2O的质量比为8:15 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com