
【题目】下列操作中,能使电离平衡H2O![]() H+ + OH-正向移动且溶液呈酸性的是( )
H+ + OH-正向移动且溶液呈酸性的是( )
A. 向水中加入NaHSO4溶液 B. 向水中加入Al2(SO4)3溶液
C. 向水中加入Na2CO3溶液 D. 将水加热到100℃,使水的pH=6
科目:高中化学 来源: 题型:
【题目】在一定温度下的恒容容器中,.当下列物理量不再发生变化时,不能表明反应:A(s)+3B(g)![]() 2C(g)+D(g)已达平衡状态的是( )
2C(g)+D(g)已达平衡状态的是( )
①气体的平均相对分子质量不再变化;②单位时间内生成amolA,同时消耗2amolC;③容器中的压强不再变化;④混合气体的密度不再变化;⑤B的浓度不再变化;⑥n(A):n(B):n(C):n(D)=1:3:2:2
A.②③⑤B.①③④⑥C.②④⑤D.②③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学给分子式为C12H26的某烷烃命名为“2,4-二甲基-3,5-二乙基己烷”,另一同学认为这样命名有错误,有关该烷烃的说法,你认为正确的是
A. 若该烷烃由单烯烃与氢气加成而得,则原单烯烃可有11种不同结构
B. 该烷烃的一氯代物有10种
C. 该烷烃正确名称应为2,4,5-三甲基-3-乙基庚烷
D. 该烷烃分子中含有5个支链
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制硫酸中的一个反应:2SO2(g)+O2(g)![]() 2SO3(g),下列有关说法错误的是( )
2SO3(g),下列有关说法错误的是( )
A.在反应条件下,SO2不可能100%转化为SO3
B.达到平衡时SO2的浓度与SO3浓度相等
C.使用催化剂能加快反应速率
D.平衡后再升高温度平衡会改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.书写共价化合物的电子式只需把结构式中的一个单键改成一对电子即可
B.已知![]() ,可见,成键的一方不提供电子也可能形成化学键
,可见,成键的一方不提供电子也可能形成化学键
C.将某种化合物溶于水,若能导电说明这种化合物是离子化合物
D.只要是离子化合物其熔点就比共价化合物的熔点高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验题
甲同学拟通过实验探究同主族元素性质的递变规律。其设计的实验方案如下,请你帮他填写完整,并做出评价。
实验室提供的试剂: NaBr溶液、NaI溶液、新制的氯水
(1)实验目的:
①写出下列实验报告中的实验现象和离子方程式
实验步骤 | 实验现象 | 实验结论及离子方程式 |
| 甲___________ 乙___________ | 离子方程式 甲___________ 乙___________ 结论:卤素单质的氧化性由强到弱的顺序为Cl2>Br2>I2 |
②【评价】甲同学设计的实验方案的合理性是___________(填序号)
A. 非常合理 B. 部分合理 C. 完全不合理
③【补充和完善】上一题②中若选A,则此项不用再作答,若选B或C,则完成实验还需要的试剂是___________。
(2)下表是元素周期表主族元素的一部分,短周期元素X的最高正化合价是+5,Y的单质可在空气中燃烧。
W | X | Y |
Z |
请回答下列问题:
①写出Z的原子结构示意图:__________________。
②探究同主族元素性质的一些共同规律,是学习化学的重要方法之一。在下表中列出对H2ZO3各种不同化学性质的推测,举例并写出相应的化学方程式(化学方程式中用Z表示即可) _____
编号 | 性质推测 | 化学方程式 |
示例 | 氧化性 | H2ZO3+4HI===Z↓+2I2+3H2O |
1 | ||
2 |
③由C、O和Y三种元素组成的化合物COY中,所有原子的最外层都满足8电子结构。写出该化合物的电子式:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将pH均为3,体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随1g![]() 的变化如右图所示。下列说法正确的是
的变化如右图所示。下列说法正确的是

A. 稀释相同倍数时:c(Aˉ)>c(Bˉ-)
B. 水的电离程度:b=c>a
C. 溶液中离子总物质的量:b>c>a
D. 溶液中离子总浓度:a>b>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铋![]() 及其化合物广泛应用于电子、医药等领域。由辉铋矿(主要成分为
及其化合物广泛应用于电子、医药等领域。由辉铋矿(主要成分为![]() ,含杂质
,含杂质![]() 、
、![]() 等)制备
等)制备![]() 的工艺如下(已知水解能力:
的工艺如下(已知水解能力:![]() )
)
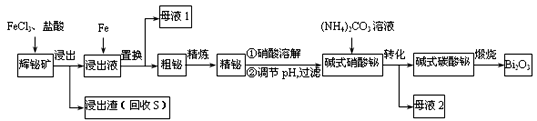
回答下列问题:
(1)为了提高浸出率,可采取的措施有_______________。(任写一条)
(2)“浸出”时![]() 与
与![]() 溶液反应的化学方程式为__________________________,盐酸的作用_________________________________________。
溶液反应的化学方程式为__________________________,盐酸的作用_________________________________________。
(3)“母液2”中主要溶质的化学式为________。
(4)“粗铋”中含有的主要杂质是Pb,可通过电解精炼除杂。电解质为熔融![]() 、KC1,电解后精铋留在粗铋电极下方电解槽底部。电解时,粗铋与电源_____(填“正”或“负”)极相连。阴极的电极反应为__________________________,铅元素的金属性比铋元素______。(填“强”“弱”或“不能确定”)。
、KC1,电解后精铋留在粗铋电极下方电解槽底部。电解时,粗铋与电源_____(填“正”或“负”)极相连。阴极的电极反应为__________________________,铅元素的金属性比铋元素______。(填“强”“弱”或“不能确定”)。
(5)碱式硝酸铋直接灼烧也能得到![]() ,上述工艺中转化为碱式碳酸铋再灼烧的优点是_________。
,上述工艺中转化为碱式碳酸铋再灼烧的优点是_________。
(6)常温下,向浓度均为![]() 的
的![]() 、
、![]() 的混合溶液中滴加
的混合溶液中滴加![]() 溶液,先生成__________沉淀,通过计算说明______________________________。[已知:Ksp(PbS) = 3.0×10-28,Ksp(Bi2S3) = 1.0×10-20]
溶液,先生成__________沉淀,通过计算说明______________________________。[已知:Ksp(PbS) = 3.0×10-28,Ksp(Bi2S3) = 1.0×10-20]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com