
| A. | 常温下将pH=2的硫酸和pH=12的MOH溶液等体积混合,所得溶液pH≤7 | |
| B. | 已知同温度相同浓度的NaNO2溶液比NaF溶液的碱性强,所以氢氟酸的酸性比亚硝酸的弱 | |
| C. | 常温下,将醋酸钠、盐酸两溶液混合后,溶液呈中性,则有c(Na+)>c(Cl-)=c(CH3COOH) | |
| D. | pH相等的NH4Cl、(NH4)2SO4、NH4HSO4三种溶液物质的量浓度为c(NH4Cl)>c((NH4)2SO4)=c(NH4HSO4) |
分析 A.MOH若是强碱,硫酸和MOH恰好反应溶液显中性,若MOH为弱碱,反应后又电离出氢氧根离子,溶液显碱性;
B.强碱弱酸盐类水解程度越大,对应弱酸的酸性越弱;
C.结合溶液中电荷守恒和物料守恒分析判断;
D.从两个角度考虑,一是相同pH的(NH4)2SO4与NH4Cl溶液的水解程度是否相等,二是NH4HSO4电离时产生H+使溶液呈酸性,NH4+的水解被抑制,以此来解答.
解答 解:A.MOH若是强碱,硫酸和MOH恰好反应溶液显中性,若MOH为弱碱,反应后又电离出氢氧根离子,溶液显碱性,温下将pH=2的硫酸和pH=12的MOH溶液等体积混合,所得溶液pH≥7,故A错误;
B.已知同温度相同浓度的NaNO2溶液比NaF溶液的碱性强,所以氢氟酸的酸性比亚硝酸的强,故B错误;
C.常温下,将醋酸钠、盐酸两溶液混合后,溶液呈中性,则有c(Na+)+c(H+)=c(Cl-)+c(OH-)+c(CH3COO-),c(Na+)=c(Cl-)+c(CH3COO-),物料守恒为:c(Na+)=c(CH3COOH)+c(CH3COO-),则有c(Na+)>c(Cl-)=c(CH3COOH),故C正确;
D.相同pH的(NH4)2SO4与NH4Cl溶液中,都是强酸弱碱盐,根据溶液呈电中性可判断二者NH4+浓度相等,由于NH4HSO4电离时产生H+使溶液呈酸性,NH4+的水解被抑制,因此NH4HSO4中NH4+的浓度小于(NH4)2SO4,c(NH4Cl)>c((NH4)2SO4)>c(NH4HSO4),故D错误;
故选C.
点评 本题考查了电解质溶液中物料守恒、电荷守恒的计算应用,主要是弱电解质电离平衡和盐类水解的原理应用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 反应Ⅰ中S单质是氧化剂 | |
| B. | 反应ⅡAl2O3中Al元素被氧化 | |
| C. | 当生成5.4 g Al时,反应Ⅰ和反应Ⅱ共转移1.2 mol e- | |
| D. | 反应Ⅰ氧化产物与还原产物物质的量之比为2:9 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
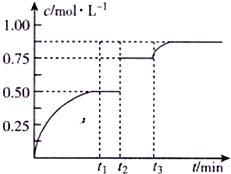 一定温度下,将1mo1X、1molY和1molW充入2L恒容密闭容器,发生反应X(g)+Y(g)?mZ(g)+W(s),t1时达到平衡.在t1、t2时刻分别改变影响反应的一个条件,测得容器中气体Z的浓度随时间变化如图所示.下列说法正确的是( )
一定温度下,将1mo1X、1molY和1molW充入2L恒容密闭容器,发生反应X(g)+Y(g)?mZ(g)+W(s),t1时达到平衡.在t1、t2时刻分别改变影响反应的一个条件,测得容器中气体Z的浓度随时间变化如图所示.下列说法正确的是( )| A. | 反应方程式中的m=2 | |
| B. | t2时刻改变的条件是加人了催化剂或加压 | |
| C. | t3时刻改变的条件是移去少里物质W | |
| D. | t3时刻改变的条件可能是增加了X的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知氢气的燃烧热为285.8kJ/mol,相应的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)═H2O(g),△H=-285.8 kJ/mol | |
| B. | 中和相同体积、相同物质的量浓度的①硫酸,②盐酸和③醋酸所需相同浓度的NaOH溶液的体积关系:V1>V2=V3 | |
| C. | 稀氨水中部分粒子的浓度大小关系:c(NH3•H2O)>c(OH-)>c(NH${\;}_{4}^{+}$)>c(H+) | |
| D. | 1mol/LNaX和1mol/LNaY两种盐溶液中c(X-)═c(Y-)+c(HY),则HX为强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝粉投入到NaOH溶液中:2Al+2OH-=═2AlO2-+H2↑ | |
| B. | 钠和水反应:Na+2H2O═Na++2OH-+H2↑ | |
| C. | NaHCO3溶液与NaOH溶液反应:OH-+HCO3-═CO32-+H2O | |
| D. | 向烧碱溶液中加入过量的CO2:CO2+2OH-═CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
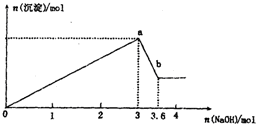 现有FeCl3、AlCl3的混合溶液100mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如图.
现有FeCl3、AlCl3的混合溶液100mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸除去水垢中:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 铜和浓硝酸反应:Cu+4H++2NO${\;}_{3}^{-}$═Cu2++2NO2↑+2H2O | |
| C. | 向氨水中通入过量SO2:2NH3•H2O+SO2═2NH${\;}_{4}^{+}$+SO${\;}_{3}^{2-}$+H2O | |
| D. | H2SO4溶液和Ba(OH)2溶液:H++SO${\;}_{4}^{2-}$+Ba2+═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非自发反应在任何条件下都不能实现 | |
| B. | 自发反应都是熵增大的反应 | |
| C. | 能自发进行的吸热反应一定是熵增大的反应 | |
| D. | 自发反应都是放热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com