
在容积为2 L的密闭容器中,一定条件下发生化学反应:2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH=-746.4 kJ·mol-1。起始反应时NO和CO各为4 mol,10秒钟后达到化学平衡,测得N2为1 mol。下列有关反应速率的说法中,正确的是( )
N2(g)+2CO2(g) ΔH=-746.4 kJ·mol-1。起始反应时NO和CO各为4 mol,10秒钟后达到化学平衡,测得N2为1 mol。下列有关反应速率的说法中,正确的是( )
A.反应前5秒钟内,用NO表示的平均反应速率为0.1 mol·L-1·s-1
B.达到平衡后,升高温度,正反应速率将减小,逆反应速率将增大
C.达到平衡后,反应速率的关系有:v正(CO)=2v逆(N2)
D.保持容器体积不变,往容器中充入1 mol O2,正、逆反应速率都不改变
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:
在一密闭容器中进行下列反应:2SO2(g)+O2(g)⇌2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol•L﹣1、0.1mol•L﹣1、0.2mol•L﹣1,当反应达到平衡时,可能存在的数据是( )
|
| A. | SO2为0.4mol•L﹣1,O2为0.2 mol•L﹣1 |
|
| B. | SO2为0.15 mol•L﹣1 |
|
| C. | SO2,SO3均为0.25 mol•L﹣1 |
|
| D. | SO3为0.4 mol•L﹣1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于甲、乙、丙、丁四个图象的说法中,正确的是( )
|
| A. |
是等质量的两份锌粉a、b分别加到过量的稀硫酸中,同时向a中加入少量CH3COONa溶液,产生H2的体积V(L)与时间t(min)的关系图 |
|
| B. |
足量CO2不断通入含KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的体积的关系图 |
|
| C. |
由图可知,双氧水在有催化剂存在时的热化学方程式为:2H2O2(l)=2H2O(l)+O2(g)△H=﹣2(Ea2′﹣Ea2) kJ•mol﹣1 |
|
| D. |
装置图能实现铁上镀锌 |
查看答案和解析>>
科目:高中化学 来源: 题型:
尿素是蛋白质代谢的产物,也是重要的化学肥料。工业合成尿素反应如下:
2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g)
CO(NH2)2(s)+H2O(g)
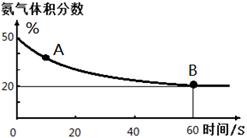 (1)在一个真空恒容密闭容器中充入CO2和NH3发生上述反应合成尿素,恒定温度下混合气体中的氨气含量如图所示。
(1)在一个真空恒容密闭容器中充入CO2和NH3发生上述反应合成尿素,恒定温度下混合气体中的氨气含量如图所示。
A点的正反应速率v正(CO2)_______B点的逆反应速率v逆(CO2)(填“>”、“<”或“=”);
氨气的平衡转化率为________________________。
(2)氨基甲酸铵是合成尿素的一种中间产物。将体积比为2:1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生下列反应并达到平衡:2NH3(g)+CO2(g)  NH2COONH4(s)
NH2COONH4(s)
将实验测得的不同温度下的平衡数据列于下表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度 (10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
①关于上述反应的焓变、熵变说法正确的是 。
A.∆H<0 ,∆S<0 B.∆H>0, ∆S<0 C.∆H>0, ∆S>0 D.∆H<0, ∆S>0
②关于上述反应的平衡状态下列说法正确的是________________
A.分离出少量的氨基甲酸铵,反应物的转化率将增大
B.平衡时降低体系温度,CO2的体积分数下降
 C.NH3的转化率始终等于CO2的转化率
C.NH3的转化率始终等于CO2的转化率
D.加入有效的催化剂能够提高氨基甲酸铵的产率
③氨基甲酸铵极易水解成碳酸铵,酸性条件水解更彻底。将氨基甲酸铵粉末逐渐加入1L0.1mol/L的盐酸溶液中直到pH=7(室温下,忽略溶液体积变化),共用去0.052mol氨基甲酸铵,此时溶液中几乎不含碳元素。
此时溶液中c(NH4+)= ;
NH4+水解平衡常数值为 。
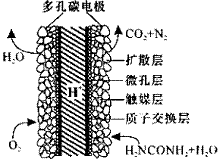
化学家正在研究尿素动力燃料电池,尿液也能发电!用这种电池直接去除城市废水中的尿素,既能产生净化的水又能发电。尿素燃料电池结构如图所示,写出该电池的负极反应式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
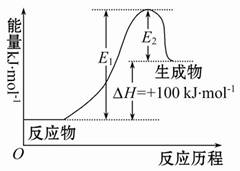
某反应的ΔH=+100 kJ·mol-1,下列有关该反应的叙述正确的是( )
A.正反应活化能小于100 kJ·mol-1
B.逆反应活化能一定小于100 kJ·mol-1
C.正反应活化能不小于100 kJ·mol-1
D.正反应活化能比逆反应活化能大100 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与生活密切相关,下列说法正确的是:
A 制作航天服的聚酯纤维属于新型无机非金属材料
B 银器久置后表面会变暗,是因为发生了电化学腐蚀
CLi是最轻的金属也是活动性很强的金属,是制造电池的理想物质
D海水提取溴、煤的液化、焰色反应都发生了化学变化。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是:
A. 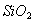 是酸性氧化物,能与溶液反应
是酸性氧化物,能与溶液反应
B. 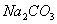 和
和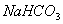 都是盐,都能与溶液反应
都是盐,都能与溶液反应
C.  和
和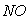 都是大气污染物,在空气中都能稳定存在
都是大气污染物,在空气中都能稳定存在
D. Al在浓盐酸中会“钝化”,能用铝槽盛放浓盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于热化学反应的描述中正确的是( )
A.HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1。则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1
B.CO(g)的燃烧热是283.0 kJ·mol-1,则2CO2(g)====2CO(g)+O2(g)反应的ΔH=+2×283.0 kJ·mol-1
C.C2H6的燃烧热为Q kJ·mol-1,则表示C2H6燃烧热的热化学方程式为2C2H6(g)+7O2(g)====4CO2(g)+6H2O(l) ΔH=-2Q kJ·mol-1
D.1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.书写热化学方程式时,只要在化学方程式的右端写上热量的符号和数值即可
B.凡是在加热或点燃条件下进行的反应都是吸热反应
C.表明反应所放出或吸收热量的化学方程式叫做热化学方程式
D.氢气在氧气中燃烧的热化学方程式是
2H2(g)+O2(g)===2H2O(l) ΔH=-483.6 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com